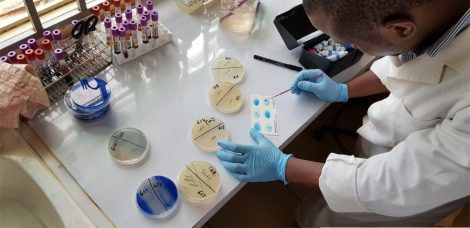
Laboratoires de référence
Les Laboratoires de référence de l’OMSA sont nommés pour suivre tous les problèmes scientifiques et techniques relatifs à une maladie. L’expert responsable de ces questions vis-à-vis de l’OMSA et de ses Pays Membres doit être un chercheur renommé, aidant le Laboratoire de référence à fournir une assistance scientifique et technique ainsi que des conseils de haut niveau sur des sujets ayant trait à la diagnostique et à la prophylaxie de la maladie dont le Laboratoire de référence est responsable. Les laboratoires doivent aussi offrir des stages de formation aux Pays Membres et coordonner des études scientifiques et techniques en collaboration avec d’autres laboratoires ou organisations, par exemple par l’intermédiaire de jumelages entre laboratoires.
- Utiliser, promouvoir et diffuser les méthodes de diagnostic validées selon les standards de l’OMSA ;
- recommander les tests prescrits ou alternatifs, ou les vaccins selon les normes de l’OMSA ;
- développer le matériel de référence selon les prescriptions de l’OMSA, et mettre en œuvre et promouvoir l’application des normes de l’OMSA ;
- conserver et distribuer aux laboratoires nationaux les produits biologiques de référence et tous autres réactifs utilisés pour le diagnostic et le contrôle des agents pathogènes ou maladies pour lesquels ils sont désignés ;
- développer, standardiser et valider selon les normes de l’OMSA, de nouvelles méthodes de diagnostic et de contrôle pour la ou les agents pathogènes ou maladies pour lesquels ils sont désignés ;
- fournir des services de diagnostic et, lorsque cela est approprié, fournir des conseils scientifiques et techniques sur les mesures de contrôle des maladies aux Pays Membres de l’OMSA ;
- conduire et/ou coordonner des études scientifiques et techniques en collaboration avec d’autres laboratoires, centres ou institutions ;
- collecter, traiter, analyser publier et diffuser les données épidémiologiques pertinentes sur les agents pathogènes ou maladies désignées ;
- proposer des informations scientifiques et techniques aux personnels des Pays Membres de l’OMSA ;
- maintenir un système d’assurance qualité et de biosécurité pertinent pour les agents pathogènes et les maladies concernées ;
- organiser et participer à des réunions scientifiques pour le compte de l’OMSA ;
- établir et animer un réseau avec les autres laboratoires de référence de l’OMSA désignés pour le même agent pathogène ou la même maladie, et organiser régulièrement des essais inter laboratoires pour assurer la comparabilité des résultats ;
- organiser des essais inter laboratoires avec d’autres laboratoires que les Laboratoires de référence de l’OMSA pour les mêmes agents pathogènes ou maladies afin d’assurer l’équivalence des résultats ;
- mettre des experts consultants à la disposition de l’OMSA.
1. Portée et contexte
En mai 2011, l’Assemblée mondiale des Délégués de l’OMSA (ci-après désignée l’Assemblée) a adopté une version actualisée du mandat et du règlement intérieur des Centres de référence de l’OMSA. Les fonctions mises en avant dans le mandat des Laboratoires de référence concernaient le développement et la recommandation de méthodes de test, le stockage et la distribution de réactifs de référence, les prestations de conseil, le soutien diagnostique, les formations destinées aux Pays membres et les obligations de notification. Depuis 2011, le mandat contient une nouvelle recommandation prévoyant que les laboratoires établissent et animent un réseau avec d’autres Laboratoires de référence de l’OMSA désignés pour le même agent pathogène ou la même maladie et qu’ils organisent régulièrement des essais d’aptitude interlaboratoires au sein du réseau afin de garantir la comparabilité des résultats, mais aussi avec des laboratoires travaillant sur les mêmes agents pathogènes et maladies mais qui ne sont pas des Laboratoires de référence de l’OMSA, afin de s’assurer de l’équivalence des résultats.
Les Laboratoires de référence de l’OMSA sont désignés pour examiner les questions scientifiques et techniques relatives à une maladie ou à un agent pathogène donnés. L’expert désigné est un membre réputé d’une équipe pluridisciplinaire dont le rôle est d’aider le Laboratoire de référence à fournir une assistance scientifique et technique et des avis techniques concernant le diagnostic et le contrôle de la maladie ou de l’agent pathogène relevant la compétence du Laboratoire de référence. Les Laboratoires de référence doivent également proposer des activités de formation scientifique et technique aux personnels des Pays membres et assurer la coordination d’études scientifiques et techniques en collaboration avec d’autres laboratoires ou organisations, y compris à travers le programme de l’OMSA de jumelages entre laboratoires.
L’intégrité et la crédibilité de l’OMSA sont étroitement liées à la qualité des contenus scientifiques auxquels l’OMSA a accès. L’OMSA dépend donc fortement des Laboratoires de référence désignés et des experts des maladies, dont les avis et le soutien scientifiques sont indispensables aussi bien au siège de l’OMSA pour ce qui concerne l’élaboration des normes, la participation aux groupes ad hoc et les prestations de conseil au sens large, qu’aux Pays membres individuellement.
Ce document sur les procédures de désignation des Laboratoires de référence de l’OMSA a été préparé par l’OMSA dans le but d’aider les Pays membres, les Laboratoires de référence de l’OMSA existants et les experts désignés, ainsi que les laboratoires candidats, à mieux comprendre les procédures en vigueur.
2. Soumission des candidatures
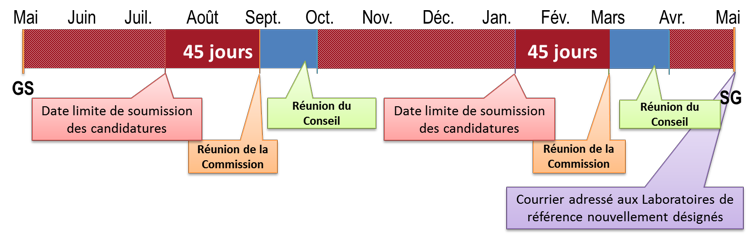
Le cycle des activités de l’OMSA est annuel, débutant chaque année au mois de mai et s’achevant au mois de mai de l’année suivante, les Sessions générales de l’Assemblée marquant le début et la fin de chaque cycle. Les Commissions spécialisées chargées de l’évaluation des candidatures au statut de Laboratoire de référence de l’OMSA se réunissent deux fois par cycle, la première réunion se tenant généralement à la fin du mois d’août ou en septembre et la seconde en février ou en mars ; ces dates peuvent varier d’une année sur l’autre en fonction de la disponibilité des membres des Commissions pertinentes (voir la Figure 1).
Les candidatures doivent être soumises 45 jours avant la date programmée pour la réunion de la Commission compétente. Cette période de 45 jours laisse suffisamment de temps à l’OMSA pour sélectionner, traduire en anglais s’il y a lieu, et traiter les dossiers qui seront évalués par la Commission. Ces échéances doivent être respectées afin de permettre une évaluation exhaustive des dossiers par les membres de la Commission avant sa réunion. Les candidatures reçues hors délai seront examinées par la Commission compétente lors de sa réunion suivante.
Les laboratoires candidats soumettront leurs informations en utilisant le modèle des Recommandations pour les candidats au statut de Laboratoire de référence de l’OMSA, que l’OMSA publie sur son site Web : https://www.woah.org/fr/ce-que-nous-proposons/reseau-dexpertise/laboratoires-de-reference/. Les dossiers ne dépasseront pas 15–20 pages au format A4 avec un texte mis en forme en interligne simple et en utilisant la police de caractères Times New Roman de taille 10. Le dossier peut inclure des annexes pertinentes qui devront être citées dans le document principal. L’ensemble des documents sera rédigé dans l’une des trois langues officielles de l’OMSA (français, anglais ou espagnol).
Lors de son évaluation des candidatures, la Commission peut décider de transmettre au laboratoire candidat des questions complémentaires. Ces demandes d’information se feront essentiellement par courrier signé par la Directrice générale de l’OMSA, après la réunion de la Commission. Le laboratoire candidat devra répondre par écrit aux questions posées dans le délai qui lui aura été signifié ou, le cas échéant, avant la date limite précédant la réunion de la Commission compétente (à savoir, 45 jours avant la date programmée de cette réunion).
3. Présélection des candidatures
Dès réception d’une candidature, le siège de l’OMSA (service des Science) adresse un courrier au laboratoire candidat accusant réception de la candidature et confirmant les dates de la réunion de la Commission compétente. En cas d’informations incomplètes, le siège de l’OMSA peut demander au laboratoire d’introduire des amendements à son dossier ou de fournir des informations complémentaires avant un délai fixé.
4. Évaluation par les Commissions spécialisées pertinentes
Les évaluations des candidatures au statut de Laboratoire de référence de l’OMSA pour les maladies des animaux terrestres ou aquatiques sont effectuées respectivement par la Commission des normes biologiques ou par la Commission des normes sanitaires pour les animaux aquatiques.
Le mandat, le Règlement intérieur des Commission ainsi que les qualifications et les procédures d’élection de leurs membres sont décrits dans les Textes fondamentaux de l’OMSA. Les membres de la Commission sont élus ou réélus par l’Assemblée tous les trois ans.
Les membres de la Commission sont soumis aux conditions et aux procédures de l’OMSA relatives à la protection de la confidentialité et à la gestion des conflits d’intérêts. Au cas où un membre de la Commission se trouverait en situation de conflit d’intérêts vis-à-vis d’une candidature particulière, le président de la Commission et le secrétariat de l’OMSA veilleront à ce que ce membre ne participe pas aux délibérations ni à la décision finale concernant la candidature en question.
Conformément au chapitre 3 [du Règlement intérieur] sur les critères de désignation des Centres de référence de l’OMSA et aux résolutions adoptées lors de chaque Session générale concernant la désignation de nouveaux Laboratoires de référence de l’OMSA pour des maladies des animaux terrestres et aquatiques, les candidatures présentées sont évaluées au regard de critères normalisés qui portent notamment sur les aspects suivants : l’aptitude, la capacité et l’engagement à fournir les services requis ; la renommée scientifique et technique de l’institution concernée au niveau national et international ; la qualité du leadership scientifique et technique de l’établissement, et plus particulièrement la reconnaissance internationale dans son domaine de compétence ; la stabilité durable de l’établissement en termes de personnel, d’activité et de financement ; l’importance technique et géographique de l’établissement et de ses activités par rapport aux priorités d’action de l’OMSA.
Au moment d’évaluer une candidature au statut de Laboratoire de référence de l’OMSA, la Commission peut prendre en compte toute information relevant du domaine public qu’elle jugera pertinente à cette fin.
Conformément aux Textes fondamentaux de l’OMSA, les échanges de correspondance officiels entre la Commission et des personnalités ou organismes extérieurs passent par le bureau de la Directrice générale de l’OMSA. Toute correspondance entre les laboratoires candidats et le siège de l’OMSA est dûment consignée par le siège de l’OMSA.
5. Approbation du Conseil de l’OMSA
Conformément à l’article 3 du chapitre 4 du Règlement intérieur et aux résolutions pertinentes adoptées antérieurement, les candidatures au statut de Laboratoire de référence sont soumises à l’approbation du Conseil avant d’être présentées à l’Assemblée pour adoption.
6. Communication au laboratoire candidat des conclusions de l’évaluation
À l’issue de sa réunion, la Commission prépare un rapport dans lequel sont énoncées les conclusions de l’évaluation des demandes présentées par les laboratoires candidats. Le rapport de la Commission désigne nommément les laboratoires candidats dont elle recommande l’approbation en tant que Laboratoires de référence. Parallèlement, chaque laboratoire candidat dont la demande est rejetée reçoit un courrier de la Directrice générale de l’OMSA l’informant des résultats de l’évaluation, résumant les points évalués et, le cas échant, demandant des éclaircissements au laboratoire ou lui exposant les motifs du rejet de sa candidature. Ce courrier de la Directrice générale de l’OMSA n’est pas publié dans le domaine public et l’identité du laboratoire n’est pas révélée dans le rapport de la Commission. Un laboratoire candidat peut aussi recevoir un courrier lui communiquant les demandes d’information complémentaire formulées par la Commission. Dans ce cas, le laboratoire candidat doit faire parvenir l’information demandée à l’OMSA avant le délai fixé afin que la Commission puisse l’examiner lors de sa prochaine réunion.
7. Désignation par l’Assemblée d’un Laboratoire de référence de l’OMSA
Les nouveaux Laboratoires de référence de l’OMSA sont désignés par l’Assemblée, au vu de l’évaluation réalisée par la Commission compétente et de l’approbation du Conseil de l’OMSA, par voie d’une résolution spécifique. La désignation d’un nouveau Laboratoire de référence de l’OMSA entre en vigueur lors de l’adoption de la résolution par l’Assemblée.
Peu après la Session générale, une lettre de confirmation et adressée par la Directrice générale aux Laboratoires de référence de l’OMSA dont la désignation vient d’être prononcée. La liste actualisée des experts et des Laboratoires de référence est ensuite mise à jour sur le site Web de l’OMSA.
8. Changements d’experts intervenus dans les Laboratoires de référence de l’OMSA
Conformément à la Résolution n° 34 adoptée lors de la 81e Session générale en mai 2013, l’Assemblée a délégué au Conseil le pouvoir d’approuver, en son nom, le remplacement des experts de l’OMSA désignés dans les Laboratoires de référence existants, à condition que les nominations soumises par le directeur du Laboratoire de référence concerné, par l’intermédiaire du Délégué auprès de l’OMSA du pays où se situe le laboratoire, aient été examinées et entérinées par la Commission spécialisée compétente.
Lorsqu’un expert décide de renoncer à son titre d’expert désigné de l’OMSA et que le laboratoire souhaite néanmoins conserver son statut de Laboratoire de référence de l’OMSA, ce dernier doit adresser un courrier officiel à l’OMSA par l’intermédiaire du Délégué du pays, par lequel il détaille la situation et propose le remplacement de l’expert en annexant le curriculum détaillé de l’expert proposé ainsi que la liste des travaux de recherche publiés par celui-ci sur la maladie ou l’agent pathogène correspondant à la désignation du laboratoire. La Commission spécialisée de l’OMSA compétente examine la nomination proposée par la Laboratoire de référence lors de la réunion qui suit la réception de ce courrier, et sa décision est ensuite notifiée au Laboratoire de référence. Le remplacement de l’expert du Laboratoire de référence de l’OMSA ne devient officiel qu’après l’approbation du Conseil.
Compte tenu des contraintes de calendrier s’appliquant aux réunions des Commissions spécialisées et du Conseil, un Laboratoire de référence de l’OMSA peut être amené à fonctionner provisoirement sans expert désigné. Toutefois, dans les circonstances normales, l’OMSA part du principe que ses Laboratoires de référence ont un expert désigné en place et qu’ils anticipent avec suffisamment d’avance les démissions ou départs à la retraite éventuels. Si la Commission spécialisée n’approuve pas la nomination d’un expert de remplacement, le Laboratoire de référence aura jusqu’à la réunion suivante de la Commission pour soumettre ou resoumettre une nomination. Pendant la période entre les réunions, le Laboratoire de référence demeurera sur la liste de l’OMSA avec la mention « A décider » remplaçant le nom de l’expert. Le laboratoire devra fournir une adresse électronique fonctionnelle pour accompagner l’inscription sur la liste de l’OMSA. Si, lors de la deuxième réunion, le Laboratoire de référence ne soumet pas une nouvelle nomination ou une nomination renouvelée, ou si la nomination n’est pas approuvée par la Commission, le Laboratoire de référence sera suspendu et retiré de la liste de l’OMSA. Le Laboratoire de référence disposera alors d’un an (deux réunions consécutives de la Commission spécialisée) pour pourvoir avec succès le poste d’expert remplaçant et être réintégré sur la liste de l’OMSA. Si au bout d’un an à compter de la radiation initiale de la liste, aucun candidat n’a été proposé et que le poste est donc vacant, la désignation du Laboratoire de référence sera retirée conformément à l’article 9 du Règlement intérieur (cf. section 10).
9. Suspension du statut de Laboratoire de référence de l’OMSA
Les Laboratoires de référence de l’OMSA sont tenus de respecter leurs TdR et leur règlement intérieur. Ils doivent avoir un expert désigné et approuvé, responsable de la mise en œuvre des aspects techniques des TdR. Si un Laboratoire de référence se trouve dans l’incapacité de remplir ses TdR pendant une période temporaire, par exemple en raison de l’absence d’une stratégie de succession entraînant l’absence d’un expert désigné agréé ou d’un manque temporaire de capacité de diagnostic dû à la construction ou à la restructuration des installations du laboratoire, le Laboratoire de référence doit en informer immédiatement le Siège de l’OMSA. Le Siège de l’OMSA, en consultation avec la Commission spécialisée concernée, peut décider de suspendre temporairement le statut OMSA du laboratoire jusqu’à ce que le laboratoire puisse fonctionner selon les normes requises pour les Laboratoires de référence de l’OMSA. La période de suspension ne devrait pas dépasser deux ans. Pendant cette période, le laboratoire sera retiré de la liste de l’OMSA. À tout moment au cours de cette période de deux ans, le statut du laboratoire pourra être rétabli après réception et acceptation par la Commission spécialisée concernée de la preuve que le Laboratoire de référence fonctionne à nouveau selon les normes requises. Si au cours de la période de deux ans, le laboratoire ne peut fournir la preuve de sa capacité opérationnelle, sa désignation sera retirée conformément à l’article 9 du Règlement intérieur (cf. section 10).
10. Révocation des Laboratoires de référence
La Commission compétente procède à l’examen des rapports d’activités des Laboratoires de référence après leur vérification et analyse préalables par le siège de l’OMSA (voir le paragraphe 11.1). La Commission est libre de recommander au Conseil et à l’Assemblée de révoquer un Laboratoire de référence dont les activités ne sont manifestement pas conformes à son mandat.
Conformément à l’article 9 du chapitre 4 du Règlement intérieur, les Laboratoires de référence peuvent renoncer à leur statut à tout moment. Un Laboratoire de référence de l’OMSA qui décide de renoncer à sa désignation doit en informer l’OMSA en lui adressant un courrier officiel par l’intermédiaire du Délégué du pays dans lequel il est situé.
En outre, conformément à l’article 9 du chapitre 4 du Règlement intérieur, la désignation d’un Laboratoire de référence doit être retirée si le Laboratoire de référence ne se conforme pas aux dispositions du mandat et du Règlement intérieur. Dans ce cas, le Directeur général de l’OMSA, après consultation de la Commission spécialisée appropriée, propose la révocation à l’Assemblée et en informe le Délégué du pays.
En 2016, les Commissions spécialisées et la Directrice générale de l’OMSA ont identifié cinq points critiques à prendre en compte au moment de l’évaluation des performances d’un laboratoire:
i) la non-soumission d’un rapport annuel ;
ii) l’absence d’accréditation du système de gestion de la qualité du laboratoire selon la norme ISO 17025 ou une norme équivalente, qui doit, dans l’idéal, préciser les tests couverts par l’accréditation ;
iii) une évolution générale révélant l’absence d’activité diagnostique ou de production et fourniture de réactifs de référence en lien avec la maladie ou l’agent pathogène correspondant à la désignation du laboratoire ;
iv) l’absence de suite donnée aux demandes d’expertise scientifique transmises par le siège de l’OMSA (par exemple, questions techniques émanant des Pays membres, révision d’un chapitre du Manuel terrestre, etc.).
v) l’absence de suite données aux demandes administratives de l’OMSA sur des questions liées à la transparence et à la confidentialité (par exemple, non-renouvellement de la déclaration relative aux conflits d’intérêt potentiels ou absence de déclaration de confidentialité.
11. Rapports annuels des Laboratoires de référence de l’OMSA
Conformément à l’article 8 du chapitre 4 du règlement intérieur, les Centres de référence de l’OMSA s’engagent à soumettre à la Directrice générale un rapport synthétique des activités relevant de leur mandat au terme de chaque année civile, en utilisant le modèle fourni par le siège de l’OMSA. Cette obligation est rappelée chaque année par la Directrice générale dans un courrier adressé aux experts désignés des Laboratoires de référence de l’OMSA.
Un système électronique opérationnel depuis décembre 2013 permet la saisie en ligne des rapports annuels des Laboratoires de référence de l’OMSA.
Le modèle du rapport annuel s’articule autour des principaux axes du mandat adopté en mai 2011 pour les Laboratoires de référence de l’OMSA. Les questions auxquelles les laboratoires doivent répondre sont de type fermé (les seules réponses possibles étant Oui ou Non), ce qui permet de compiler des données précises et comparables. Les tableaux inclus dans le modèle sont destinés à recueillir des informations détaillées sur les activités réalisées par les laboratoires. La plate-forme électronique en ligne destinée à recueillir les rapports annuels est accessible via un lien dédié ; le courrier adressé par la Directrice générale de l’OMSA aux experts des Laboratoires de référence de l’OMSA attribue à chacun un nom d’utilisateur et un mot de passe, générés de manière aléatoire, leur donnant accès à la plate-forme. La date limite de soumission du rapport annuel des Laboratoires de référence de l’OMSA pour les activités d’une année civile est généralement fixée à la fin du mois de janvier de l’année suivante.
11.1. Examen et analyse des rapports annuels
Une première vérification et l’analyse quantitative des rapports annuels reçus sont effectuées par le siège de l’OMSA, en se basant sur les réponses aux questions de type fermé (oui/non). Un résumé de cette analyse est présenté à la Commission compétente lors de sa réunion de février/mars.
Le rapport annuel permet de démontrer que les Laboratoires de référence de l’OMSA s’acquittent des tâches qu’ils se sont engagés à effectuer, conformément au mandat adopté par l’Assemblée de l’OMSA.
Toute question ou incertitude de la Commission apparues lors de l’examen des rapports annuels sont transmises aux Laboratoires de référence de l’OMSA concerné par l’intermédiaire du bureau de la Directrice générale de l’OMSA.
Les Pays membres peuvent consulter la totalité des rapports annuels des Laboratoires de référence de l’OMSA, où ils sont publiés peu après la réunion de février de la Commission compétente.
11.2. Non-soumission du rapport annuel
Après la réunion des Commissions compétentes, un courrier est adressé aux laboratoires qui n’ont pas soumis de rapport annuel, avec copie au Délégué du Pays membre concerné, l’enjoignant à adresser ce rapport à l’OMSA dans un délai prescrit. Si le rapport n’est pas parvenu à l’OMSA à la fin du mois de mars, un courrier est adressé directement au Délégué, avec copie à l’expert, lui demandant d’expliquer au plus tard dans les deux semaines qui suivent, la situation ou les circonstances ayant amené le laboratoire à ne pas se conformer à cette disposition du mandat.
Des échanges ultérieurs par courrier ou des entretiens directs lors de la Session générale peuvent être envisagés, si besoin, avant que la Commission, lors de sa réunion de septembre, ne prenne la décision finale de recommander la révocation du laboratoire. Cette procédure est également applicable aux laboratoires présentant un manquement à l’un des quatre autres critères de révocation (voir le point 10 ci‑dessus).
Contact : [email protected]
Agalaxie contagieuse
-
Dr Guido Loria
ITALIE
Adresse
Istituto Zooprofilattico Sperimentale della Sicilia
Via G. Marinuzzi 3, 90129 PalermoCoordonnées
+39-091 656 53 07
[email protected]
-
Dr Anne Ridley
ROYAUME-UNI
Adresse
Mycoplasma Group, Department of Statutory and Exotic Bacterial Diseases
Animal and Plant Health Agency, New Haw, Addlestone, Weybridge, Surrey KT15 3NBCoordonnées
+44-1932 35 73 79
[email protected]
Anaplasmose
-
Dr Juan Joel Mosqueda Gualito
MEXIQUE
Adresse
Centro Nacional de Servicios de Constatación en Salud Animal (CENAPA)
Carretera Cuernavaca Cuautla #8534 Colonia Progreso CB 62550, Jiutepec Morelos MorelosCoordonnées
+52-777 3.19.02.02
[email protected]
Anémie infectieuse des équidés
-
Dr Maria Teresa Scicluna
ITALIE
Adresse
Division for the Diagnosis of Viral Diseases and Leptospirosis
Istituto Zooprofillatico Sperimentale delle Regioni Lazio e Toscana (IZSLT) Via Appia Nuova 1411 00178 Rome RomeCoordonnées
+390-6 79.09.93.15
[email protected]
-
Dr Xiaojun Wang
RÉPUBLIQUE POPULAIRE DE CHINE
Adresse
Laboratory of Equine Infectious Anemia, Harbin Veterinary Research Institute of Chinese Academy of Agricultural Sciences
427 Maduan Street, Harbin 150001Coordonnées
+86-189 46.06.60.85
[email protected]
Artérite virale équine
-
Prof. Falko Steinbach
ROYAUME-UNI
Adresse
Animal and Plant Health Agency
New Haw, Addlestone, Weybridge, Surrey KT15 3NBCoordonnées
+44-1932 35 75 66
[email protected]
-
To Be Decided
ÉTATS-UNIS D'AMÉRIQUE
Coordonnées
+1-859 257 47 57 ext. 81094
[email protected]
Avortement enzootique des brebis (chlamydiose ovine)
-
Dr Christiane Schnee
ALLEMAGNE
Adresse
Institute of Molecular PathogenesisFriedrich-Loeffler-InstituteFederal Research Institute for Animal Health
Naumburger Str. 96a 07743 Jena JenaCoordonnées
+49-3641 804 2435
[email protected]
-
Dr Karine Laroucau
FRANCE
Adresse
ANSES (French Agency for Food, Environmental and Occupational Health & Safety)
Animal Health Laboratory (Maisons-Alfort), Bacterial Zoonoses Unit, 14 rue Pierre et Marie Curie, 94701 Maisons-Alfort CedexCoordonnées
+330149771350
[email protected]
-
Dr. Nicole Borel
SUISSE
Adresse
Institute for Veterinary Pathology (IVPZ),
Vetsuisse Faculty, University of Zurich, Winterhurerstrasse 268, Zurich, CH-8057Coordonnées
+41446358571
[email protected]
Babésiose
-
Dr Valeria Blanda
ITALIE
Adresse
Italian Reference Centre for Anaplasma, Babesia, Rickettsia, Theileria (C.R.A.Ba.R.T.)
Istituto Zooprofilattico Sperimentale della Sicilia (IZSSi), via Gino Marinuzzi 3, 90129, PalermoCoordonnées
+39-091 656.53.41 ext 219
[email protected]
-
Dr Juan Joel Mosqueda Gualito
MEXIQUE
Adresse
Centro Nacional de Servicios de Constatación en Salud Animal (CENAPA)
Carretera Cuernavaca Cuautla #8534 Colonia Progreso CB 62550, Jiutepec Morelos MorelosCoordonnées
+52-777 3.19.02.02
[email protected]
Babésiose bovine
-
Prof. Naoaki Yokoyama
JAPON
Adresse
Obihiro University of Agriculture and Veterinary Medicine Nishi 2-13, Inada-cho Obihiro, Hokkaido 080-8555 Hokkaido
Coordonnées
+81-155 49.56.49
[email protected]
Brucellose (Brucella abortus)
-
Dr. Heinrich Neubauer
ALLEMAGNE
Adresse
Institute of Bacterial Infections and Zoonoses, Friedrich-Loeffer Institute,
Naumburger Str. 96a, 07743 JenaCoordonnées
+49-3641 804 2100
[email protected]
[email protected]
[email protected]
-
Dra. Ana Maria Nicola
ARGENTINE
Adresse
Dirección General de Laboratorios y Control Técnico, Servicio Nacional de Sanidad y Calidad Agroalimentaria (SENASA)
Talcahuano 1660, Código Postal 1640, Martinez, Buenos AiresCoordonnées
+54-11 48 74 67 31 (Ext. 2631 or 2730)
[email protected]
[email protected]
-
Dr Jin-Ju Lee
CORÉE (RÉP. DE)
Adresse
Brucellosis Laboratory, Bacteriology DivisionAnimal and Plant Quarantine Agency (QIA)Ministry of Agriculture, Food and Rural Affairs (MAFRA)
177, Hyeoksin 8-ro, Gimcheon-si, Gyeongsangbuk-do, 39660 Gyeongsangbuk-doCoordonnées
+82-54 912 0754
[email protected]
-
Dr Mahmoud Hamdy
EGYPTE
Adresse
Department of Brucellosis Research
Animal Health Research Institute, Agricultural Research Center, Ministry of Agriculture and Land Reclamation, 7 Nadi El-Said Street, P.O. Box 12618, Dokki, GizaCoordonnées
+201 222.28.14.76
[email protected]
[email protected]
-
Dr Claire Ponsart
FRANCE
Adresse
ANSES (French Agency for Food, Environmental and Occupational Health & Safety)
Animal Health Laboratory (Maisons-Alfort), Bacterial Zoonoses Unit, 14 rue Pierre et Marie Curie, F-94701 Maisons-Alfort CedexCoordonnées
+33149771350
[email protected]
-
Dr. Svetlana Berdenstein
ISRAËL
Adresse
Kimron Veterinary Institute, Department of Bacteriology
P.O. Box 12, Beit Dagan 50250Coordonnées
+972-3 968 16 98
[email protected]
-
Dr Fabrizio De Massis
ITALIE
Adresse
Istituto Zooprofilattico Sperimentaledell'Abruzzo e del Molise 'G. Caporale'
Via Campo Boario 64100 Teramo TERAMOCoordonnées
+390-861 33 22 41
[email protected]
-
Dr Adrian Whatmore
ROYAUME-UNI
Adresse
Animal and Plant Health Agency
New Haw, Addlestone, Weybridge, Surrey KT15 3NBCoordonnées
+44-1932 35.76.10
[email protected]
-
Prof. Liangquan Zhu
RÉPUBLIQUE POPULAIRE DE CHINE
Coordonnées
+861062103630
[email protected]
[email protected]
-
Dr Monaya Ekgatat
THAÏLANDE
Adresse
National Institute of Animal Health
50/2 Kasetklang Ladyao Chatuchak Bangkok 10900 THAILANDCoordonnées
+66-2579 89.08 to 14 ext. 232
[email protected]
-
Prof. Ulrich Wernery
ÉMIRATS ARABES UNIS
Adresse
Central Veterinary Research Laboratory
P.O. Box 597 Dubai DubaiCoordonnées
+971-4 337.51.65
[email protected]
Brucellose (Brucella canis)
-
Prof. Ulrich Wernery
ÉMIRATS ARABES UNIS
Adresse
Central Veterinary Research Laboratory
P.O. Box 597 Dubai DubaiCoordonnées
+971-4 337.51.65
[email protected]
Brucellose (Brucella melitensis)
-
Dr. Heinrich Neubauer
ALLEMAGNE
Adresse
Institute of Bacterial Infections and Zoonoses, Friedrich-Loeffer Institute,
Naumburger Str. 96a, 07743 JenaCoordonnées
+49-3641 804 2100
[email protected]
[email protected]
[email protected]
-
Dra. Ana Maria Nicola
ARGENTINE
Adresse
Dirección General de Laboratorios y Control Técnico, Servicio Nacional de Sanidad y Calidad Agroalimentaria (SENASA)
Talcahuano 1660, Código Postal 1640, Martinez, Buenos AiresCoordonnées
+54-11 48 74 67 31 (Ext. 2631 or 2730)
[email protected]
[email protected]
-
Dr Mahmoud Hamdy
EGYPTE
Adresse
Department of Brucellosis Research
Animal Health Research Institute, Agricultural Research Center, Ministry of Agriculture and Land Reclamation, 7 Nadi El-Said Street, P.O. Box 12618, Dokki, GizaCoordonnées
+201 222.28.14.76
[email protected]
[email protected]
-
Dr Claire Ponsart
FRANCE
Adresse
ANSES (French Agency for Food, Environmental and Occupational Health & Safety)
Animal Health Laboratory (Maisons-Alfort), Bacterial Zoonoses Unit, 14 rue Pierre et Marie Curie, F-94701 Maisons-Alfort CedexCoordonnées
+33149771350
[email protected]
-
Dr. Svetlana Berdenstein
ISRAËL
Adresse
Kimron Veterinary Institute, Department of Bacteriology
P.O. Box 12, Beit Dagan 50250Coordonnées
+972-3 968 16 98
[email protected]
-
Dr Fabrizio De Massis
ITALIE
Adresse
Istituto Zooprofilattico Sperimentaledell'Abruzzo e del Molise 'G. Caporale'
Via Campo Boario 64100 Teramo TERAMOCoordonnées
+390-861 33 22 41
[email protected]
-
Dr Adrian Whatmore
ROYAUME-UNI
Adresse
Animal and Plant Health Agency
New Haw, Addlestone, Weybridge, Surrey KT15 3NBCoordonnées
+44-1932 35.76.10
[email protected]
-
Prof. Liangquan Zhu
RÉPUBLIQUE POPULAIRE DE CHINE
Coordonnées
+861062103630
[email protected]
[email protected]
-
Dr Monaya Ekgatat
THAÏLANDE
Adresse
National Institute of Animal Health
50/2 Kasetklang Ladyao Chatuchak Bangkok 10900 THAILANDCoordonnées
+66-2579 89.08 to 14 ext. 232
[email protected]
-
Prof. Ulrich Wernery
ÉMIRATS ARABES UNIS
Adresse
Central Veterinary Research Laboratory
P.O. Box 597 Dubai DubaiCoordonnées
+971-4 337.51.65
[email protected]
Brucellose (Brucella suis)
-
Dr. Heinrich Neubauer
ALLEMAGNE
Adresse
Institute of Bacterial Infections and Zoonoses, Friedrich-Loeffer Institute,
Naumburger Str. 96a, 07743 JenaCoordonnées
+49-3641 804 2100
[email protected]
[email protected]
[email protected]
-
Dra. Ana Maria Nicola
ARGENTINE
Adresse
Dirección General de Laboratorios y Control Técnico, Servicio Nacional de Sanidad y Calidad Agroalimentaria (SENASA)
Talcahuano 1660, Código Postal 1640, Martinez, Buenos AiresCoordonnées
+54-11 48 74 67 31 (Ext. 2631 or 2730)
[email protected]
[email protected]
-
Dr Claire Ponsart
FRANCE
Adresse
ANSES (French Agency for Food, Environmental and Occupational Health & Safety)
Animal Health Laboratory (Maisons-Alfort), Bacterial Zoonoses Unit, 14 rue Pierre et Marie Curie, F-94701 Maisons-Alfort CedexCoordonnées
+33149771350
[email protected]
-
Dr Fabrizio De Massis
ITALIE
Adresse
Istituto Zooprofilattico Sperimentaledell'Abruzzo e del Molise 'G. Caporale'
Via Campo Boario 64100 Teramo TERAMOCoordonnées
+390-861 33 22 41
[email protected]
-
Dr Adrian Whatmore
ROYAUME-UNI
Adresse
Animal and Plant Health Agency
New Haw, Addlestone, Weybridge, Surrey KT15 3NBCoordonnées
+44-1932 35.76.10
[email protected]
-
Prof. Liangquan Zhu
RÉPUBLIQUE POPULAIRE DE CHINE
Coordonnées
+861062103630
[email protected]
[email protected]
Bursite infectieuse (Maladie de Gumboro)
-
Dr Nicolas Eterradossi
FRANCE
Adresse
ANSES (French Agency for Food, Environmental and Occupational Health & Safety)
Ploufragan-Plouzané-Niort Laboratory, Poultry and Rabbit Virology, Immunology, Parasitology Unit, B.P. 53, 22440 PloufraganCoordonnées
+33 (0)2 96 01 62 22
[email protected]
-
Dr. Yulong Gao
RÉPUBLIQUE POPULAIRE DE CHINE
Adresse
Division of Avian Immunosuppressive Disease, Harbin Veterinary Research Institute (HVRI)
Chinese Academy of Agricultural Sciences (CAAS), 678 Haping Road, Xiangfang District, Harbin 150069Coordonnées
+8618945083045864
[email protected]
Cachexie chronique
-
Dr. Gordon Mitchell
CANADA
Adresse
Canadian Food Inspection Agency, Ottawa Laboratory (Fallowfield), Animal Disease Research Institute
3851 Fallowfield Road, P.O. Box 11300, Station H, Nepean, Ontario K2H 8P9nCoordonnées
+1-613 221.48.54
[email protected]
-
Dr Hyun-Joo Sohn
CORÉE (RÉP. DE)
Adresse
Prion Disease Research Laboratory, Division of Foreign Animal DiseaseAnimal and Plant Quarantine Agency (QIA)Ministry of Agriculture, Food and Rural Affairs (MAFRA)
177, Hyeoksin 8-ro, Gimcheon-si, Gyeongsangbuk-do, 39660 Gyeongsangbuk-doCoordonnées
+82-54 912 0862
[email protected]
-
Dr. Sylvie L. Benestad
NORVÈGE
Adresse
Norwegian Veterinary Institute (NVI)
Pb 64, N-1431 ÅsCoordonnées
+47-23 21.60.00
[email protected]
[email protected]
-
Dr. Aaron Lehmkuhl
ÉTATS-UNIS D'AMÉRIQUE
Campylobactérioses
-
Dr. Jaap Wagenaar
PAYS-BAS
Adresse
Department of Infectious Diseases and Immunology,
Faculty of Veterinary Medicine, trecht University, PO Box 80.165, 3508 TD UtrechtCoordonnées
+31-320 23 81 57
[email protected]
Chlamydiose aviaire
-
Dr Christiane Schnee
ALLEMAGNE
Adresse
Institute of Molecular PathogenesisFriedrich-Loeffler-InstituteFederal Research Institute for Animal Health
Naumburger Str. 96a 07743 Jena JenaCoordonnées
+49-3641 804 2435
[email protected]
-
Dr Karine Laroucau
FRANCE
Adresse
ANSES (French Agency for Food, Environmental and Occupational Health & Safety)
Animal Health Laboratory (Maisons-Alfort), Bacterial Zoonoses Unit, 14 rue Pierre et Marie Curie, 94701 Maisons-Alfort CedexCoordonnées
+330149771350
[email protected]
Clavelée et variole caprine
-
Dr Baratang Alison Lubisi
AFRIQUE DU SUD
Adresse
Senior Research Veterinarian
Onderstepoort Veterinary Institute, Agricultural Research Council, Private Bag X05, Onderstepoort 0110Coordonnées
+27-12 529 91 17
[email protected]
-
Dr. Mohammad Hassan Ebrahimi-jam
IRAN
Adresse
RAZI Vaccine & Serum Research Institute
Karaj 3197619751, Teheran,Coordonnées
+982634570038
[email protected]
[email protected]
-
Georgina Limon-Vega
ROYAUME-UNI
Adresse
Pirbright,
Ash Road, Woking, Surrey GU24 0NFCoordonnées
+44-1483 23.24.41
[email protected]
Cowdriose
-
Dr Valérie Rodrigues
FRANCE
Adresse
UMR ASTRE : Animal, Santé, Territoires, Risques, Ecosystèmes ; CIRAD Département BIOS
Domaine Duclos – Prise-D'eau 97170 Petit-Bourg, GuadeloupeCoordonnées
+33 (0)4 67 59 37 39
[email protected]
Cysticercose
-
Dr Xuenong Luo
RÉPUBLIQUE POPULAIRE DE CHINE
Adresse
Department of Parasitology, State Key Laboratory of Veterinary Etiological Biology, Lanzhou Veterinary Research Institute,
Chinese Academy of Agricultural Sciences, 1 Xujiaping, Lanzhou, Gansu Province 730046,Coordonnées
+86-931 832.39.78
[email protected]
Dermatose nodulaire contagieuse
-
Dr. Antoinette Van Schalkwyk
AFRIQUE DU SUD
Adresse
Senior Researcher
Onderstepoort Veterinary Institute, Agricultural Research Council, Private Bag X05, Onderstepoort 0110,Coordonnées
+27125299108
[email protected]
-
Dr. Nick De Regge
BELGIQUE
Coordonnées
+3223790514
[email protected]
-
Georgina Limon-Vega
ROYAUME-UNI
Adresse
Pirbright,
Ash Road, Woking, Surrey GU24 0NFCoordonnées
+44-1483 23.24.41
[email protected]
Diarrhée virale bovine
-
Dr Kerstin Wernike
ALLEMAGNE
Adresse
Institute of Diagnostic Virology
Friedrich-Loeffler-Institut Federal Research Institute for Animal Health Südufer 10 17493 Greifswald – Insel Riems Insel RiemsCoordonnées
+49-38351 7-1212
[email protected]
-
Dr. Peter Kirkland
AUSTRALIE
Adresse
Elizabeth Macarthur Agriculture Institute (EMAI), Virology Laboratory
Woodbridge Rd, Menangle, PMB 8, Camden NSW 2570Coordonnées
+61-2 46.40.63.31
[email protected]
[email protected]
-
Dr. Oliver Lung
CANADA
Adresse
Canadian Food Inspection Agency,
National Centre for Animal Disease (NCAD), P.O. Box 640, Township Road 9-1, Lethbridge, Alberta T1J 3Z4Coordonnées
+1-403 382 55 00
[email protected]
-
Dr Rebecca Strong
ROYAUME-UNI
Adresse
Animal and Plant Health Agency
New Haw, Addlestone, Weybridge, Surrey KT15 3NBCoordonnées
+44-208 415 2102
[email protected]
Dourine
-
Dr Laurent Hébert
FRANCE
Adresse
ANSES (French Agency for Food, Environmental and Occupational Health & Safety)
Animal Health Laboratory (Normandy site), Physiopathology and Epidemiology of Equine Diseases Unit, 14430 DozuléCoordonnées
+33-(0)2 31.79.22.76
[email protected]
Ehinococcose (Echinococcus granulosus et E. multilocularis)
-
Dr Giovanna Masala
ITALIE
Adresse
National Reference Laboratory for Cyctic Echinococcosis (CE)
Istituto Zooprofilattico Sperimentale (IZS) of SardiniVia Duca degli Abruzzi, 807100 Sassari,, SassariCoordonnées
+39-079 289 200
[email protected]
[email protected]
Encéphalite japonaise
-
Dr Dong-Kun Yang
CORÉE (RÉP. DE)
Adresse
Animal and Plant Quarantine Agency
177 Hyeoksin 8-ro Gimcheong-si Gyeongsangbuk-do 39660 GyeongsangbukCoordonnées
+82 31 467.1783
[email protected]
Encéphalopathie et rétinopathie virales
-
Dr Anna Toffan
ITALIE
Adresse
Istituto Zooprofilattico Sperimentale delle Venezie, Fish Virology Dept
Viale dell'Università, 10,35020 Legnaro (Padova)Coordonnées
+39-049 808 43 88
[email protected]
Encéphalopathie spongiforme bovine
-
Dr. Waqas Tahir
CANADA
Adresse
Lethbridge Laboratory
Canadian Food Inspection Agency, National Centre for Animal Disease (NCAD), Lethbridge Laboratory, Lethbridge T1J 3Z4Coordonnées
+1-403 382.55.49
[email protected]
-
Dr Juan José Badiola Díez
ESPAGNE
Adresse
Centro de investigación en Encefalopatías y enfermedades transmisibles emergentes
Universidad de Zaragoza, Facultad de Veterinaria, Departamento de Patología Animal, Miguel Servet 177, 50013 ZaragozaCoordonnées
+34-976 76 20 19
[email protected]
-
Dr Cristina Casalone
ITALIE
Adresse
Italian National Reference Centre for Diagnostic Activities in Stranded Marine Mammals (C.Re.Di.Ma.), via Bologna 148, 10154 TorinoCoordonnées
+39-11 26 86 296
[email protected]
[email protected]
-
Dr. Yoshifumi Iwamaru
JAPON
Adresse
National Agricultural Research Organization, Prion Diseases Research Unit, National Institute of Animal Health
3-1-5 Kannondai, Tsukuba, Ibaraki 305-0856Coordonnées
+81-29 838 83 33
[email protected]
-
Dr John Spiropoulos
ROYAUME-UNI
Adresse
Animal and Plant Health Agency
New Haw, Addlestone, Weybridge, Surrey KT15 3NBCoordonnées
+44 1932 357.564
[email protected]
-
Prof. Torsten Seuberlich
SUISSE
Adresse
Neuro Centre Department of Clinical Research and Veterinary Public Health
Division of Experimental Clinical Research, University of Bern, Bremgartenstrasse 109 A3012 Bern,Coordonnées
+41-31 631 22 06
[email protected]
Entérosepticémie du poisson-chat (Edwardsiella ictaluri)
-
Dr Larry A. Hanson
ÉTATS-UNIS D'AMÉRIQUE
Adresse
Fish Diagnostic Laboratory, College of Veterinary Medicine, Mississippi State University
P.O. Box 6100, Spring Street, Mississippi 39762Coordonnées
+1-662 325 12 02
[email protected]
Epididymite ovine (Brucella ovis)
-
Dra. Ana Maria Nicola
ARGENTINE
Adresse
Dirección General de Laboratorios y Control Técnico, Servicio Nacional de Sanidad y Calidad Agroalimentaria (SENASA)
Talcahuano 1660, Código Postal 1640, Martinez, Buenos AiresCoordonnées
+54-11 48 74 67 31 (Ext. 2631 or 2730)
[email protected]
[email protected]
-
Dr Claire Ponsart
FRANCE
Adresse
ANSES (French Agency for Food, Environmental and Occupational Health & Safety)
Animal Health Laboratory (Maisons-Alfort), Bacterial Zoonoses Unit, 14 rue Pierre et Marie Curie, F-94701 Maisons-Alfort CedexCoordonnées
+33149771350
[email protected]
-
Dr Fabrizio De Massis
ITALIE
Adresse
Istituto Zooprofilattico Sperimentaledell'Abruzzo e del Molise 'G. Caporale'
Via Campo Boario 64100 Teramo TERAMOCoordonnées
+390-861 33 22 41
[email protected]
-
Dr Adrian Whatmore
ROYAUME-UNI
Adresse
Animal and Plant Health Agency
New Haw, Addlestone, Weybridge, Surrey KT15 3NBCoordonnées
+44-1932 35.76.10
[email protected]
Escherichia coli
-
Dr John Morris Fairbrother
CANADA
Adresse
The Escherichia coli Laboratory (EcL)Faculty of Veternary Medicine, University of Montreal
3200 Sicotte Saint-Hyacinthe Québec J2S 2M2 QuébecCoordonnées
+1-450 773.85.21
[email protected]
Fièvre Q
-
Dr Elodie Rousset
FRANCE
Adresse
ANSES (French Agency for Food, Environmental and Occupational Health & Safety)
Sophia-Antipolis Laboratory, Animal Q fever, 105, route des Chappes, BP 111, 06902 Sophia-AntipolisCoordonnées
+33-4 92.94.37.00
[email protected]
-
Dr. Agnieszka Jodelko
POLOGNE
Adresse
National Veterinary Research Institute, Department of Cattle and Sheep Diseases
Al. Partyzantow str. 5724-100 PulawyCoordonnées
+48818893274
[email protected]
[email protected]
Fièvre aphteuse
-
Dr Livio Heath
AFRIQUE DU SUD
Adresse
Onderstepoort Veterinary Institute,
Agricultural Research Council, Private Bag X05, Onderstepoort 0110Coordonnées
+27-12 529 95.01
[email protected]
-
Dra. Sabrina Galdo
ARGENTINE
-
Dr. Joseph Hyera
BOTSWANA
-
Dr Edviges Maristela Pituco
BRÉSIL
Adresse
PANAFTOSA
Av. President Kennedy 7778 25040-000 Duque de Caxias Rio de Janeiro Rio de JaneiroCoordonnées
+55-21 36.61.90.64
[email protected]
-
Dr. Charles Nfon
CANADA
Adresse
National Centre for Foreign Animal Disease, Canadian Food Inspection Agency
Canadian Science Centre for Human and Animal Health, 1015 Arlington Street, Suite T2300, Winnipeg, Manitoba R3E 3M4Coordonnées
+1-204 789.20.23
[email protected]
-
Dr. Sang-Ho Cha
CORÉE (RÉP. DE)
Adresse
Division of Foot and Mouth Disease, Animal and Plant Quarantine Agency (QIA), Ministry of Agriculture, Food and Rural Affairs
177, Hyeoksin 8-ro, Gimcheon-si, Gyeongsangbuk-do, 39660Coordonnées
+82549120774
[email protected]
-
Dr Bakkali Kassimi Labib
FRANCE
Adresse
ANSES (French Agency for Food, Environmental and Occupational Health & Safety)
Animal Health Laboratory (Maisons-Alfort), Virology unit, 14 rue Pierre et Marie Curie, 94701 Maisons-Alfort CedexCoordonnées
+330149771350
[email protected]
-
Santina Grazioli
ITALIE
Adresse
Istituto Zooprofilattico Sperimentale della Lombardia e dell'Emilia Romagna (IZSLER)
Via A. Bianchi No. 9, 25124 BresciaCoordonnées
+390-30 229 03 10
[email protected]
-
Dr Donald King
ROYAUME-UNI
Adresse
Vesicular Disease Reference Laboratories
Ash Road, Pirbright Woking, Surrey, GU24 0NF PirbrightCoordonnées
+44-1483 23.10.21
[email protected]
-
Dr. Valery Zakharov
RUSSIE
Adresse
Federal Governmental Institute, Centre for Animal Health (FGI-ARRIAH)
600900 Yur'evets, VladmirCoordonnées
+7-4922 26 06 14
[email protected]
[email protected]
-
Dr Xiangtao Liu
RÉPUBLIQUE POPULAIRE DE CHINE
Adresse
Lanzhou Veterinary Research Institute, CAAS, National Foot and Mouth Disease Reference Laboratory
Xujiaping No.1, Yanchangpu, Lanzhou, Gansu Province 730046Coordonnées
+86-931 834.25.85
[email protected]
[email protected]
-
Vivian O'Donnell
ÉTATS-UNIS D'AMÉRIQUE
Adresse
National Veterinary Services Laboratories, USDA, APHIS, VS
40550 Route 25, Orient, New York, NY 11957Coordonnées
+16313233300
[email protected]
Fièvre catarrhale du mouton
-
Dr Baratang Alison Lubisi
AFRIQUE DU SUD
Adresse
Senior Research Veterinarian
Onderstepoort Veterinary Institute, Agricultural Research Council, Private Bag X05, Onderstepoort 0110Coordonnées
+27-12 529 91 17
[email protected]
-
Dr Debbie Eagles
AUSTRALIE
Adresse
CSIRO
5 Portarlington Road, Private Bag 24 (Ryrie Street), Geelong 3220, VictoriaCoordonnées
+61-3 52 27 00 00
[email protected]
-
Dr Giovanni Savini
ITALIE
Adresse
Istituto Zooprofilattico Sperimentale dell'Abruzzo e del Molise "G. Caporale"
Via Campo Boario, 64100 TeramoCoordonnées
+39-0861 33 24 40
[email protected]
-
Dr. Carrie Batten
ROYAUME-UNI
Fièvre charbonneuse
-
Dr. Kingsley Amoako
CANADA
-
Ms Ginger Harvey
ÉTATS-UNIS D'AMÉRIQUE
Adresse
National Veterinary Services Laboratory, USDA, APHIS, VS
1920 Dayton Avenue, Ames, Iowa 50010Coordonnées
+15153377070
[email protected]
Fièvre de West Nile
-
Dr Federica Monaco
ITALIE
Adresse
Istituto Zooprofilattico Sperimentale dell'Abruzzo e del Molise "G. Caporale"
Via Campo Boario, 64100 TeramoCoordonnées
+39 0861 33.22.05
[email protected]
Fièvre de la Vallée du Rift
-
Dr Baratang Alison Lubisi
AFRIQUE DU SUD
Adresse
Senior Research Veterinarian
Onderstepoort Veterinary Institute, Agricultural Research Council, Private Bag X05, Onderstepoort 0110Coordonnées
+27-12 529 91 17
[email protected]
-
Dre. Catherine Cetre-Sossah
FRANCE
Grippe porcine
-
Dr Chiara Chiapponi
ITALIE
-
Dr. Junki Mine
JAPON
Adresse
Viral Disease and Epidemiology Research Division, National Institute of Animal Health, National Agriculture and Food Research Organization
Kannondai, Tsukuba, Ibaraki, 305-0856Coordonnées
+81298387704
[email protected]
-
To Be Decided
ROYAUME-UNI
Adresse
WOAH/FAO International Reference Laboratory for Avian Influenza
Animal and Plant Health Agency – Weybridge, Addlestone, Surrey KT15 3NBCoordonnées
+441483232441
[email protected]
[email protected]
-
Dr. Mia Kim Torchetti
ÉTATS-UNIS D'AMÉRIQUE
Adresse
National Veterinary Services Laboratories, USDA, APHIS, VS
1920 Dayton Avenue, Ames, Iowa 50010Coordonnées
+15153377551
[email protected]
Grippe équine
-
Prof. Ann Cullinane
IRLANDE
Adresse
Irish Equine Centre
Johnstown, Naas, Co. KildareCoordonnées
+353-45 86.62.66
[email protected]
-
Dr Manabu Nemoto
JAPON
Adresse
Equine Research Institute, Japan Racing Association
1400-4 Shiba, Shimotsuke, Tochigi 329-0412Coordonnées
+81-285 44.0090
[email protected]
[email protected]
-
Dr Thomas M. Chambers
ÉTATS-UNIS D'AMÉRIQUE
Adresse
Department of Veterinary Science
Maxwell H. Gluck Equine Research Center, University of Kentucky, 108 Gluck Equine Research Center, Lexington, Kentucky 40546-0099Coordonnées
+1-859 257 47 57
[email protected]
Herpèsvirose du poisson-chat
-
Dr Larry A. Hanson
ÉTATS-UNIS D'AMÉRIQUE
Adresse
Fish Diagnostic Laboratory, College of Veterinary Medicine, Mississippi State University
P.O. Box 6100, Spring Street, Mississippi 39762Coordonnées
+1-662 325 12 02
[email protected]
Herpèsvirose du saumon masou
-
Dr Hisae Kasai
JAPON
Adresse
Laboratory of Biotechnology and Microbiology Faculty of Fisheries Science Hokkaido University
3-1-1 Minato-Cho Hakodate Hokkaido 041-8611 HOKKAIDOCoordonnées
+81-138 40 88 98
[email protected]
Infección por el virus de la viremia primaveral de la carpa
-
Richard Paley
ROYAUME-UNI
Coordonnées
+441305206642
[email protected]
-
Dr. Hong Liu
RÉPUBLIQUE POPULAIRE DE CHINE
Adresse
Animal and Plant Inspection and Quarantine Technical Center, Shenzhen Customs District
General Administration of Customs, P. R. China (GACC), Building 1011 of Fuqiang Road, Futianqu, Shenzhen, Guangdong Province, 518045Coordonnées
+86-755 25 58 84 10
[email protected]
[email protected]
Infection due à l’herpèsvirus de l’ormeau
-
Dr Nick Moody
AUSTRALIE
Adresse
CSIRO Australian Centre for Disease Preparedness
5 Portarlington Road, Private Bag 24 (Ryrie Street), Geelong 3220, VictoriaCoordonnées
+61-3 52 27 00 00
[email protected]
Infection par l'alphavirus des salmonidés
-
Dr. Hilde Sindre
NORVÈGE
Adresse
Norwegian Veterinary Institute
Pb 64, N-1431 ÅsCoordonnées
+47 23.21.60.00
[email protected]
[email protected]
Infection par l'herpèsvirus de la carpe koï
-
Dr. Heike Schutze
ALLEMAGNE
Adresse
German Reference Laboratory for Koi Herpesvirus Disease (KHVD)
Institute of Infectology (IMED), Friedrich-Loeffler-Institut (FLI), Federal Research Institute for Animal Health, Institute of Infectology, Südufer 10, 17493 Greifswald – Insel RiemsCoordonnées
+493835171254
[email protected]
-
Dr Takafumi Ito
JAPON
Adresse
Aquaculture Research Department, Fisheries Technology Institute,
Japan Fisheries Research and Education Agency, Nakatsuhamaura 422-1, Minami-ise, Mie 516-0193Coordonnées
+81599661872
[email protected]
-
Dr. Irene Cano Cejas
ROYAUME-UNI
Adresse
The Centre for Environment, Fisheries and Aquaculture Science (CEFAS)Weymouth Laboratory
Barrack Road, The Nothe, Weymouth, Dorset DT4 8UB WeymouthCoordonnées
+44-1305 20.66.42
[email protected]
Infection par l'iridovirus de la daurade japonaise
-
Dr Yasuhiko Kawato
JAPON
Adresse
National Research Institute of Aquaculture Fisheries Research Agency
422-1 Nakatsuhamaura Minami-ise, Mie 516-0193 MieCoordonnées
+81-599 66.18.30
[email protected]
Infection par le génotype 1 du virus de la tête jaune
-
Dr Nick Moody
AUSTRALIE
Adresse
CSIRO Australian Centre for Disease Preparedness
5 Portarlington Road, Private Bag 24 (Ryrie Street), Geelong 3220, VictoriaCoordonnées
+61-3 52 27 00 00
[email protected]
Infection par le nodavirus de Macrobrachium rosenbergii (Maladie des queues blanches)
-
Dr A.Sait Sahul Hameed
INDE
Adresse
C.Abdul Hakeem College Aquatic Animal Health Laboratory Department of Zoology
Melvisharam-632 509 Ranipet District, Tamil Nadu Tamil NaduCoordonnées
+91-4172 26.94.87
[email protected]
Infection par le virus de la nécrose hypodermique et hématopoïétique infectieuse
-
Dr Bing Yang
RÉPUBLIQUE POPULAIRE DE CHINE
Adresse
Maricultural Organism Disease Control and Molecular Pathology Laboratory, Yellow Sea Fisheries Research Institute
Chinese Academy of Fishery Sciences, 106 Nanjing Road, Qingdao, Shandong 266071Coordonnées
+86 532 858 230 62
[email protected]
-
Dr Arun Dhar
ÉTATS-UNIS D'AMÉRIQUE
Adresse
Aquaculture Pathology Laboratory, School of Animal and Comparative Biomedical Sciences
University of Arizona, 1117 E Lowell St, Building 90, 85721 TucsonCoordonnées
+1-520 621 87.27
[email protected]
Infection par le virus de la nécrose hématopoïétique infectieuse
-
Dr Kyle Garver
CANADA
Adresse
Pacific Biological Station – Aquatic Animal Health Laboratory (PBS-AAHL)
Fisheries & Oceans Canada, 3190 Hammond Bay Road, Nanaimo V9T 6N7, British ColumbiaCoordonnées
+1-250 756 73 40
[email protected]
-
Dr. Hong Liu
RÉPUBLIQUE POPULAIRE DE CHINE
Adresse
Animal and Plant Inspection and Quarantine Technical Center, Shenzhen Customs District
General Administration of Customs, P. R. China (GACC), Building 1011 of Fuqiang Road, Futianqu, Shenzhen, Guangdong Province, 518045Coordonnées
+86-755 25 58 84 10
[email protected]
[email protected]
Infection par le virus de la nécrose hématopoïétique épizootique
-
Dr Nick Moody
AUSTRALIE
Adresse
CSIRO Australian Centre for Disease Preparedness
5 Portarlington Road, Private Bag 24 (Ryrie Street), Geelong 3220, VictoriaCoordonnées
+61-3 52 27 00 00
[email protected]
Infection par le virus de la septicémie hémorragique virale
-
Dr Kyle Garver
CANADA
Adresse
Pacific Biological Station – Aquatic Animal Health Laboratory (PBS-AAHL)
Fisheries & Oceans Canada, 3190 Hammond Bay Road, Nanaimo V9T 6N7, British ColumbiaCoordonnées
+1-250 756 73 40
[email protected]
-
Dr Hyoung Jun Kim
CORÉE (RÉP. DE)
Adresse
Pathology Research Division in Aquaculture Research Department
National Institute of Fisheries Science (NIFS), Ministry of Oceans and Fisheries, 216 Gijanghaean-ro, Gijang-eup, Busan, 46082Coordonnées
+82-51 720.2114
[email protected]
-
Dr Britt Bang Jansen
DANEMARK
Adresse
National Institute for Aquatic Resources
Kemitorvet, Building 202 2800 Kgs, Lyngby LyngbyCoordonnées
+45 35 88 68 31
[email protected]
Infection par le virus de l’anémie infectieuse du saumon
-
Dr. Sergio Hernán Marshall González
CHILI
Adresse
Aquaculture Pathology Laboratory,
Pontifical Catholic University of Valparaíso, Curauma Campus, Avenida Universidad 330, ValparaísoCoordonnées
+56322274828
[email protected]
[email protected]
-
Dr. Ole Bendik Dale
NORVÈGE
Adresse
Norwegian Veterinary Institute
Pb 64, N-1431 ÅsCoordonnées
+47-23 21 60 00
[email protected]
[email protected]
Infection par le virus du syndrome de Taura
-
Dr Arun Dhar
ÉTATS-UNIS D'AMÉRIQUE
Adresse
Aquaculture Pathology Laboratory, School of Animal and Comparative Biomedical Sciences
University of Arizona, 1117 E Lowell St, Building 90, 85721 TucsonCoordonnées
+1-520 621 87.27
[email protected]
Infection par le virus du syndrome des points blancs
-
Dr Qingli Zhang
RÉPUBLIQUE POPULAIRE DE CHINE
Adresse
Maricultural Organism Disease Control and Molecular Pathology Laboratory Yellow Sea Fisheries Research Institute
Chinese Academy of Fishery Sciences 106 Nanjing Road, Qingdao Shandong 266071 CHINA (PEOPLE'S REP. OF)Coordonnées
+86 532 858 230 62 ext 812
[email protected]
-
Prof. Han-Ching Wang
TAIPEI CHINOIS
Adresse
International Center for the Scientific Development of Shrimp Aquaculture (ICDSA), National Cheng Kung University (NCKU)
No. 500, Sec. 3, Anming Road, Annan District, Tainan City 709Coordonnées
+886-6 384 24 48
[email protected]
-
Dr Arun Dhar
ÉTATS-UNIS D'AMÉRIQUE
Adresse
Aquaculture Pathology Laboratory, School of Animal and Comparative Biomedical Sciences
University of Arizona, 1117 E Lowell St, Building 90, 85721 TucsonCoordonnées
+1-520 621 87.27
[email protected]
Infection à Aphanomyces astaci (peste de l’écrevisse)
-
Dr Satu Viljamaa-Dirks
FINLANDE
Adresse
Finnish Food Safety Authority
Ruokavirasto Kuopio Neulaniementie 4 70210 Kuopio KUOPIOCoordonnées
+358 447.20.14.69
[email protected]
Infection à Bonamia exitiosa
-
Dr Isabelle Arzul
FRANCE
Adresse
IFREMER
Laboratoire de Génétique Aquaculture et Pathologie de Mollusques Marins 17390 La Tremblade La TrembladeCoordonnées
+33 5 46.76.26.10
[email protected]
[email protected]
Infection à Bonamia ostreae
-
Dr Isabelle Arzul
FRANCE
Adresse
IFREMER
Laboratoire de Génétique Aquaculture et Pathologie de Mollusques Marins 17390 La Tremblade La TrembladeCoordonnées
+33 5 46.76.26.10
[email protected]
[email protected]
Infection à Gyrodactylus salaris
-
Dr. Haakon Hansen
NORVÈGE
Adresse
Norwegian Veterinary Institute
Pb 64, N-1431 ÅsCoordonnées
+47-23 21.61.23
[email protected]
[email protected]
Infection à Hepatobacter penaei (hépatopancréatite nécrosante)
-
Dr Arun Dhar
ÉTATS-UNIS D'AMÉRIQUE
Adresse
Aquaculture Pathology Laboratory, School of Animal and Comparative Biomedical Sciences
University of Arizona, 1117 E Lowell St, Building 90, 85721 TucsonCoordonnées
+1-520 621 87.27
[email protected]
Infection à Marteilia refringens
-
Dr Isabelle Arzul
FRANCE
Adresse
IFREMER
Laboratoire de Génétique Aquaculture et Pathologie de Mollusques Marins 17390 La Tremblade La TrembladeCoordonnées
+33 5 46.76.26.10
[email protected]
[email protected]
Infection à Marteilia sydneyi
-
Dr Isabelle Arzul
FRANCE
Adresse
IFREMER
Laboratoire de Génétique Aquaculture et Pathologie de Mollusques Marins 17390 La Tremblade La TrembladeCoordonnées
+33 5 46.76.26.10
[email protected]
[email protected]
Infection à Mikrocytos mackini
-
Dr Cathryn Abbot
CANADA
Adresse
Department of Fisheries and Oceans, Pacific Biological Station
3190 Hammond Bay Road, Nanaimo, British Colombia V9T 6N7Coordonnées
+12506186166
[email protected]
Infection à ranavirus
-
Dr Nick Moody
AUSTRALIE
Adresse
CSIRO Australian Centre for Disease Preparedness
5 Portarlington Road, Private Bag 24 (Ryrie Street), Geelong 3220, VictoriaCoordonnées
+61-3 52 27 00 00
[email protected]
Infestation des abeilles mellif`eres par Tropilaelaps spp.
-
Dr Stéphanie Franco
FRANCE
Adresse
ANSES (French Agency for Food, Environmental and Occupational Health & Safety)
Sophia Antipolis Laboratory, Honey Bee Pathology Unit, Les Templiers 105 route des Chappes, CS 20111, 06902 Sophia AntipolisCoordonnées
+33 (0)4 92 94 37 00
[email protected]
Infestation des abeilles mellifères par Aethina tumida (le petit coléoptère des ruches)
-
Dr Marc O. Schäfer
ALLEMAGNE
Adresse
National Reference Laboratory for Bee Diseases, Friedrich-Loeffer-Institut
Federal Research Institute for Animal Health, Institute of Infectology, Südufer 1017493 Greifswald – Insel RiemsCoordonnées
+49-38351 7 1246
[email protected]
-
Dr Stéphanie Franco
FRANCE
Adresse
ANSES (French Agency for Food, Environmental and Occupational Health & Safety)
Sophia Antipolis Laboratory, Honey Bee Pathology Unit, Les Templiers 105 route des Chappes, CS 20111, 06902 Sophia AntipolisCoordonnées
+33 (0)4 92 94 37 00
[email protected]
Influenza aviaire
-
Dr Timm C. Harder
ALLEMAGNE
Adresse
Friedrich Loeffler InstituteFederal Research Institute for Animal HealthInstitute of Diagnostic Virology
Südufer 10 D-17493 Greifswald Insel Riems GREIFSWALDCoordonnées
+49-38351 7 1152
[email protected]
-
Dr. Frank Wong
AUSTRALIE
Adresse
CSIRO Australian Centre for Disease Preparedness
5 Portarlington Road, Private Bag 24 (Ryrie Street), Geelong 3220, VictoriaCoordonnées
+61-3 52 27 50 00
[email protected]
[email protected]
-
Dr Dilmara Reischak
BRÉSIL
Adresse
Laboratório Federal de Defesa Agropecuária em Sao Paulo – LFDA-SPUnidade de Sanidade Aviária
Rua Raul Ferrari, s/n° Jardim Santa Marcelina CEP 13100-105 Campinas SP Sao PauloCoordonnées
+55-19 32.52.31.74
[email protected]
-
Dr. Yohannes Berhane
CANADA
Adresse
Canadian Food Inspection AgencyNational Centre for Foreign Animal Disease
1015 Arlington Street Winnipeg, Manitoba R3E 3M4 WINNIPEGCoordonnées
+1-204 789 20 03
[email protected]
-
Dr. Eun Kyoung Lee
CORÉE (RÉP. DE)
Adresse
Animal and Plant Quarantine Agency
Ministry of Agriculture, Forest and Rural Affairs, 177, Hyeoksin 8-ro, Gimcheon-si, Gyeongsangbuk-do 39660Coordonnées
+82549120968
[email protected]
-
Dr Abdelsatar Arafa
EGYPTE
Adresse
Reference Laboratory for Veterinary Quality Control on Poultry Production
Animal Health Research Institute, Agriculture research Centre, Ministry of Agriculture and Land Reclamation, 7 Nadi el Seidst. Dokki, GizaCoordonnées
+202-33 37.09.58
[email protected]
-
Dr Chakradhar Tosh
INDE
Adresse
Indian Council of Agricultural Research (ICAR), National Institute of High Security Animal Diseases (NIHSAD)
Anand Nagar, Bhopal 462 021 Madhya Pradesh, BhopalCoordonnées
+91-755 275 92 04
[email protected]
[email protected]
-
Dr Isabella Monne
ITALIE
Adresse
Istituto Zooprofilattico Sperimentale delle Venezie, Research and Innovation Dept.
Viale Dell'Università 10, 35020 Legnaro PDCoordonnées
+39-049 808 4381
[email protected]
-
Prof. Yoshihiro Sakoda
JAPON
Adresse
Hokkaido University, Research Center for Zoonosis Control
North 20, West 10 Kita-Ku, Sapporo 001-0020Coordonnées
+81-11 706 52 07
[email protected]
-
To Be Decided
ROYAUME-UNI
Adresse
WOAH/FAO International Reference Laboratory for Avian Influenza
Animal and Plant Health Agency – Weybridge, Addlestone, Surrey KT15 3NBCoordonnées
+441483232441
[email protected]
[email protected]
-
Dr. Viktor N. Irza
RUSSIE
Adresse
National Reference Laboratory for Avian Influenza and Newcastle Disease
Federal State-Financed Institution “Federal Centre for Animal Health” (FGBI “ARRIAH”), Yur'evets, Vladimir 60090Coordonnées
+7-4922 26 18 67
[email protected]
[email protected]
-
Dr Hualan Chen
RÉPUBLIQUE POPULAIRE DE CHINE
Adresse
National Avian Influenza Reference Laboratory, Animal Influenza Laboratory of the Ministry of Agriculture
Harbin Veterinary Research Institute, 427 Maduan Street, Harbin 150001Coordonnées
+86-451 85.93.50.79
[email protected]
-
Dr. Mia Kim Torchetti
ÉTATS-UNIS D'AMÉRIQUE
Adresse
National Veterinary Services Laboratories, USDA, APHIS, VS
1920 Dayton Avenue, Ames, Iowa 50010Coordonnées
+15153377551
[email protected]
Leishmaniose
-
Dr Fabrizio Vitale
ITALIE
Adresse
Dept Molecular Biology
Istituto Zooprofilattico Sperimentale della Sicilia (IZSSi), National Reference Centre for Leishmaniasis (C.Re.Na.L.), via Gino Marinuzzi 3, 90129, Palermo PalermoCoordonnées
39-091 656.53.68
[email protected]
Leptospirose
-
Dra. Jessica Petrakovsky
ARGENTINE
Adresse
Laboratorio de Leptospirosis, Dirección General de Laboratorios y Control Técnico, Servicio Nacional de Sanidad y Calidad Agroalimentaria (SENASA)
Avenida Talcahuano N° 1660 (1640), Martínez, Pcia de Buenos AiresCoordonnées
+54-11 48.36.11.14 int 287 o 299
[email protected]
-
Dr. Luis Samartino
ARGENTINE
Adresse
CICVyA INTA, Instituto de Bacteriología
Casilla de Correo 25, Castelar 1712, Moron, Provincia de Buenos AiresCoordonnées
+541146211289
[email protected]
-
Dr. Paula Ristow
PAYS-BAS
Adresse
Academic Medical Center, Department of Medical Microbiology and Infection Prevention
University of Amsterdam, Meibergdreef 39, 1105 AZ AmsterdamCoordonnées
+31205665431
[email protected]
-
Dr. Matthew Erdman
ÉTATS-UNIS D'AMÉRIQUE
Adresse
National Veterinary Services Laboratories, USDA, APHIS, VS
1920 Dayton Avenue, Ames, Iowa 50010Coordonnées
+15153377200
[email protected]
[email protected]
[email protected]
Leucose bovine enzootique
-
Dr Jacek Kuzmak
POLOGNE
Adresse
National Veterinary Research Institute
Al. Partyzantow str. 57 24-100 Pulawy PulawyCoordonnées
+48-81 889.31.14
[email protected]
-
Dr Bhudipa Choudhury
ROYAUME-UNI
Adresse
Animal and Plant Health Agency
New Haw, Addlestone, Weybridge, Surrey KT15 3NBCoordonnées
+44-1932 35.75.59
[email protected]
Loque américaine (infection des abeilles mellifères à Paenibacillus larvae)
-
Dr Marc O. Schäfer
ALLEMAGNE
Adresse
National Reference Laboratory for Bee Diseases, Friedrich-Loeffer-Institut
Federal Research Institute for Animal Health, Institute of Infectology, Südufer 1017493 Greifswald – Insel RiemsCoordonnées
+49-38351 7 1246
[email protected]
-
Dr Marie-Pierre Chauzat
FRANCE
Adresse
ANSES (French Agency for Food, Environmental and Occupational Health & Safety)
Sophia Antipolis Laboratory, Honey Bee Pathology Unit, Les Templiers 105 route des Chappes, CS 20111, 06902 Sophia AntipolisCoordonnées
+33 (0)4 92 94 37 00
[email protected]
-
Dr. Richard J. Hall
NOUVELLE-ZÉLANDE
Coordonnées
+6448945600
[email protected]
Loque européenne (infection des abeilles mellifères à Melissococcus plutonius)
-
Dr Marie-Pierre Chauzat
FRANCE
Adresse
ANSES (French Agency for Food, Environmental and Occupational Health & Safety)
Sophia Antipolis Laboratory, Honey Bee Pathology Unit, Les Templiers 105 route des Chappes, CS 20111, 06902 Sophia AntipolisCoordonnées
+33 (0)4 92 94 37 00
[email protected]
Maladie d'Aujeszky
-
Dr Marie-Frédérique Le Potier
FRANCE
Adresse
ANSES (French Agency for Food, Environmental and Occupational Health & Safety)
Ploufragan-Plouzané-Niort Laboratory, Porcine Virology Immunology Unit, B.P. 53, 22440 PloufraganCoordonnées
+33 (0)2 96 01 62 90
[email protected]
Maladie de Marek
-
Dr. Yongxiu Yao
ROYAUME-UNI
Maladie de Newcastle
-
Dr Christian Grund
ALLEMAGNE
Adresse
Institute of Diagnostic Virology, Friedrich-Loeffler-Institute
Federal Research Institute for Animal Health, Südufer 10, D-17493 Greifswald, Insel RiemsCoordonnées
+49-38351 7 1196
[email protected]
-
Dr Dilmara Reischak
BRÉSIL
Adresse
Laboratório Federal de Defesa Agropecuária em Sao Paulo – LFDA-SPUnidade de Sanidade Aviária
Rua Raul Ferrari, s/n° Jardim Santa Marcelina CEP 13100-105 Campinas SP Sao PauloCoordonnées
+55-19 32.52.31.74
[email protected]
-
Dr Ji-Ye Kim
CORÉE (RÉP. DE)
Adresse
Newcastle disease Laboratory, Avian Disease division, Animal and Plant Quarantine Agency (QIA)
Ministry of Agriculture, Food and Rural Affairs (MAFRA), 177, Hyeoksin 8-ro, Gimcheon-si, Gyeongsangbuk-do, 39660Coordonnées
+82-54 912 0968
[email protected]
-
Dr Isabella Monne
ITALIE
Adresse
Istituto Zooprofilattico Sperimentale delle Venezie, Research and Innovation Dept.
Viale Dell'Università 10, 35020 Legnaro PDCoordonnées
+39-049 808 4381
[email protected]
-
To Be Decided
ROYAUME-UNI
Adresse
WOAH/FAO International Reference Laboratory for Avian Influenza
Animal and Plant Health Agency – Weybridge, Addlestone, Surrey KT15 3NBCoordonnées
+441483232441
[email protected]
[email protected]
-
Dr. Viktor N. Irza
RUSSIE
Adresse
National Reference Laboratory for Avian Influenza and Newcastle Disease
Federal State-Financed Institution “Federal Centre for Animal Health” (FGBI “ARRIAH”), Yur'evets, Vladimir 60090Coordonnées
+7-4922 26 18 67
[email protected]
[email protected]
-
Dr Zhiliang Wang
RÉPUBLIQUE POPULAIRE DE CHINE
Adresse
National Surveillance and Research Center for Exotic Animal Diseases
China Animal Health and Epidemiology Center, 369 Nanjing Road, Qingdao 266032Coordonnées
+86-532 85.63.91.66
[email protected]
[email protected]
-
Dr. Mia Kim Torchetti
ÉTATS-UNIS D'AMÉRIQUE
Adresse
National Veterinary Services Laboratories, USDA, APHIS, VS
1920 Dayton Avenue, Ames, Iowa 50010Coordonnées
+15153377551
[email protected]
Maladie de nécrose hépatopancréatique aiguë
-
Prof. Han-Ching Wang
TAIPEI CHINOIS
Adresse
International Center for the Scientific Development of Shrimp Aquaculture (ICDSA), National Cheng Kung University (NCKU)
No. 500, Sec. 3, Anming Road, Annan District, Tainan City 709Coordonnées
+886-6 384 24 48
[email protected]
-
Dr Arun Dhar
ÉTATS-UNIS D'AMÉRIQUE
Adresse
Aquaculture Pathology Laboratory, School of Animal and Comparative Biomedical Sciences
University of Arizona, 1117 E Lowell St, Building 90, 85721 TucsonCoordonnées
+1-520 621 87.27
[email protected]
Maladie hémorragique du lapin
-
Dr. Patrizia Cavadini
ITALIE
Adresse
Istituto Zooprofilattico Sperimentale della Lombardia e dell'Emilia Romagna 'B. Ubertini'
Via A. Bianchi No. 7/9, 25124 Brescia,Coordonnées
+39-30 229 06 17
[email protected]
Maladie hémorragique épizootique
-
Dr Stephan Zientara
FRANCE
Adresse
ANSES (French Agency for Food, Environmental and Occupational Health & Safety)
Animal Health Laboratory (Maisons-Alfort), Virology unit, 14 rue Pierre et Marie Curie, 94701 Maisons-AlfortCoordonnées
+33149771350
[email protected]
Maladie vésiculeuse du porc
-
Giulia Pezzoni
ITALIE
Adresse
Istituto Zooprofilattico Sperimentale della Lombardia e dell'Emilia Romagna (IZSLER)
Via A. Bianchi No. 9, 25124 BresciaCoordonnées
+390302290310
[email protected]
-
Dr Donald King
ROYAUME-UNI
Adresse
Vesicular Disease Reference Laboratories
Ash Road, Pirbright Woking, Surrey, GU24 0NF PirbrightCoordonnées
+44-1483 23.10.21
[email protected]
Maladies dues aux virus Hendra et Nipah
-
Dr. Kim Halpin
AUSTRALIE
Adresse
CSIRO Australian Centre for Disease Preparedness
5 Portarlington Road, Private Bag 24 (Ryrie Street), Geelong 3220, VictoriaCoordonnées
+61-3 52 27 00 00
[email protected]
[email protected]
Morve
-
Dr. Heinrich Neubauer
ALLEMAGNE
Adresse
Institute of Bacterial Infections and Zoonoses, Friedrich-Loeffer Institute,
Naumburger Str. 96a, 07743 JenaCoordonnées
+49-3641 804 2100
[email protected]
[email protected]
[email protected]
-
Dr Karine Laroucau
FRANCE
Adresse
ANSES (French Agency for Food, Environmental and Occupational Health & Safety)
Animal Health Laboratory (Maisons-Alfort), Bacterial Zoonoses Unit, 14 rue Pierre et Marie Curie, 94701 Maisons-Alfort CedexCoordonnées
+330149771350
[email protected]
-
Prof. Ulrich Wernery
ÉMIRATS ARABES UNIS
Adresse
Central Veterinary Research Laboratory
P.O. Box 597 Dubai DubaiCoordonnées
+971-4 337.51.65
[email protected]
Mycoplasmose aviaire (Mycoplasma gallisepticum)
-
To be decided
CUBA
Adresse
MYCOLAB Laboratorio para diagnóstico de micoplasmas, Centro Nacional de Sanidad Agropecuaria
San José de las Lajas Provincia Mayabeque CUBACoordonnées
+53-47 86.33.14 ext. 153
[email protected]
-
Dr. Salvatore Catania
ITALIE
-
Dr. Umit Özdemir
RÉPUBLIQUE DE TÜRKIYE
Adresse
Pandik Veterinary Control Institute
Batı mahallesi, Erol Kaya caddesi 1, 34890 İstanbulCoordonnées
+90-216 390.12.80
[email protected]
Mycoplasmose aviaire (Mycoplasma synoviae)
-
To be decided
CUBA
Adresse
MYCOLAB Laboratorio para diagnóstico de micoplasmas, Centro Nacional de Sanidad Agropecuaria
San José de las Lajas Provincia Mayabeque CUBACoordonnées
+53-47 86.33.14 ext. 153
[email protected]
-
Dr. Salvatore Catania
ITALIE
-
Dr. Umit Özdemir
RÉPUBLIQUE DE TÜRKIYE
Adresse
Pandik Veterinary Control Institute
Batı mahallesi, Erol Kaya caddesi 1, 34890 İstanbulCoordonnées
+90-216 390.12.80
[email protected]
Myiase `a Cochliomyia hominivorax
-
Dr. John B. Welch
PANAMA
Myxomatose
-
Dr. Antonio Lavazza
ITALIE
Adresse
Dept. Animal Health and Welfare
Via Antonio Bianchi 9, 25124 BresciaCoordonnées
+39-030 22.90.617
[email protected]
Métrite contagieuse équine
-
Dr Sandrine Petry
FRANCE
Adresse
ANSES (French Agency for Food, Environmental and Occupational Health & Safety)
Animal Health Laboratory (Normandy site), Physiopathology and Epidemiology of Equine Diseases Unit, 14430 DozuléCoordonnées
+330231797971
[email protected]
-
Dr. Ian Mawhinney
ROYAUME-UNI
Adresse
Animal and Plant Health Agency Bury St Edmunds
Rougham Hill, Bury St Edmunds, Suffolk IP44 2RXCoordonnées
+441284724499
[email protected]
-
Dr. Kristina Lantz
ÉTATS-UNIS D'AMÉRIQUE
Nagana : infections `a trypanosomes salivaires
-
Dr Marc Desquesnes
FRANCE
Adresse
UMR177-Intertryp (CIRAD-IRD)CIRAD-bios
Campus international de Baillarguet TA A-17 / G 34398 Montpellier Cedex 5 MontpellierCoordonnées
+33-(0)4 67 59 37 24
[email protected]
Nosémose des abeilles mellifères
-
Dr Marie-Pierre Chauzat
FRANCE
Adresse
ANSES (French Agency for Food, Environmental and Occupational Health & Safety)
Sophia Antipolis Laboratory, Honey Bee Pathology Unit, Les Templiers 105 route des Chappes, CS 20111, 06902 Sophia AntipolisCoordonnées
+33 (0)4 92 94 37 00
[email protected]
Paratuberculose
-
Dr Bernardo Alonso
ARGENTINE
Adresse
DILAB (Dirección de Laboratorios y Control Técnico) Servicio Nacional de Sanidad y Calidad, Agroalimentaria (SENASA)
Talcahuano 1660,1640 Martínez, Prov. de Buenos AiresCoordonnées
+54-11 48.74.67.35
[email protected]
[email protected]
-
Dr Virginie Poisson
FRANCE
Adresse
ANSES (French Agency for Food, Environmental and Occupational Health & Safety)
Ploufragan-Plouzané- Niort Laboratory, 60 rue de Pied-de-Fond, CS 28440, 79024 Niort CedexCoordonnées
+33 (0)5 49.79.61.28
[email protected]
-
Dr. Matteo Ricchi
ITALIE
Peste bovine
-
Dr. Arnaud Bataille
FRANCE
Adresse
CIRAD-Bios
Campus International de Baillarguet TA A-15/G, 34398 Montpellier Cedex 5Coordonnées
+33 (0)4 67 59 37 98
[email protected]
-
Dr Takehiro Kokuho
JAPON
Adresse
Exotic Disease Research DivisionNational Institute of Animal Health (NIAH)
National Agriculture and Food Research Organization (NARO) Josuihoncho 6-20-1 Kodaira Tokyo, 187-0022 TokyoCoordonnées
+81-42 321.14 66
[email protected]
-
Dr Michael Baron
ROYAUME-UNI
Adresse
Ash Road, Pirbright Woking, Surrey, GU24 0NFCoordonnées
+44-1483 23.24.41
[email protected]
-
Dr. Wei Jia
ÉTATS-UNIS D'AMÉRIQUE
Adresse
National Veterinary Services Laboratories, USDA, APHIS, VS
40550 Route 25, Orient, New York, NY 11957Coordonnées
+16313233197
[email protected]
Peste des petits ruminants
-
Dr. Arnaud Bataille
FRANCE
Adresse
CIRAD-Bios
Campus International de Baillarguet TA A-15/G, 34398 Montpellier Cedex 5Coordonnées
+33 (0)4 67 59 37 98
[email protected]
-
Dr Michael Baron
ROYAUME-UNI
Adresse
Ash Road, Pirbright Woking, Surrey, GU24 0NFCoordonnées
+44-1483 23.24.41
[email protected]
-
Dr Zhiliang Wang
RÉPUBLIQUE POPULAIRE DE CHINE
Adresse
National Surveillance and Research Center for Exotic Animal Diseases
China Animal Health and Epidemiology Center, 369 Nanjing Road, Qingdao 266032Coordonnées
+86-532 85.63.91.66
[email protected]
[email protected]
Peste porcine africaine
-
Dr Livio Heath
AFRIQUE DU SUD
Adresse
Onderstepoort Veterinary Institute,
Agricultural Research Council, Private Bag X05, Onderstepoort 0110Coordonnées
+27-12 529 95.01
[email protected]
-
Dr David Williams
AUSTRALIE
Adresse
CSIRO Australian Centre for Disease Preparedness
5 Portarlington Road, Geelong, Victoria 3220Coordonnées
+61 52.27.50.00
[email protected]
-
Dr Aruna Ambagala
CANADA
Adresse
National Centre for Foreign Animal Disease, Canadian Food Inspection Agency
1015 Arlington Street, Winnipeg, Manitoba R3E 3M4Coordonnées
+12047892089
[email protected]
[email protected]
-
Dr José Manuel Sánchez-Vizcaíno
ESPAGNE
Adresse
Centro de Vigilancia Sanitaria Veterinaria (VISAVET) Facultad de VeterinariaHCV Planta sótanoUniversidad Complutense de Madrid (UCM)
Avda Puerta de Hierro s/n, 28040 MadridCoordonnées
+34-91 394.40.82
[email protected]
-
Dr Linda Dixon
ROYAUME-UNI
Adresse
Ash Road, Pirbright Woking, Surrey, GU24 0NF Pirbright
Coordonnées
+44-1483 23 24 41
[email protected]
-
Dr Zhiliang Wang
RÉPUBLIQUE POPULAIRE DE CHINE
Adresse
National Surveillance and Research Center for Exotic Animal Diseases
China Animal Health and Epidemiology Center, 369 Nanjing Road, Qingdao 266032Coordonnées
+86-532 85.63.91.66
[email protected]
[email protected]
-
Dr. Ping Wu
ÉTATS-UNIS D'AMÉRIQUE
Adresse
National Veterinary Services Laboratories, USDA, APHIS, VS
40550 Route 25, Orient, New York, NY 11957Coordonnées
+16313233287
[email protected]
Peste porcine classique
-
Prof. Paul Becher
ALLEMAGNE
Adresse
University of Veterinary Medicine of Hannover Department of Infectious DiseasesInstitute of Virology
Bünteweg 17 30559 Hannover HANOVRECoordonnées
+49-511 953 88 40
[email protected]
-
Dr. Trevor Drew
AUSTRALIE
Adresse
CSIRO Australian Centre for Disease Preparedness
5 Portarlington Road, Geelong, Victoria 3220Coordonnées
+61 52.27.50.00
[email protected]
-
Dr Aruna Ambagala
CANADA
Adresse
National Centre for Foreign Animal Disease, Canadian Food Inspection Agency
1015 Arlington Street, Winnipeg, Manitoba R3E 3M4Coordonnées
+12047892089
[email protected]
[email protected]
-
Dra. Llilianne Ganges
ESPAGNE
-
Dr Katsuhiko Fukai
JAPON
Adresse
National Institute of Animal HealthDepartment of Exotic Diseases
6-20-1 Josui-Honcho Kodaira Tokyo 187-0022 TOKYOCoordonnées
+81-42 321 14 41
[email protected]
-
Dr Katarzyna Podgórska
POLOGNE
Adresse
National Veterinary Research Institute
Partyzantow Str. 57 24-100 Pulawy PULAWYCoordonnées
+48-81 889 30 47
[email protected]
[email protected]
-
Dr Helen Crooke
ROYAUME-UNI
Adresse
Animal and Plant Health Agency
New Haw, Addlestone, Weybridge, Surrey KT15 3NBCoordonnées
+44-208 026 9665
[email protected]
-
Prof. Qin Wang
RÉPUBLIQUE POPULAIRE DE CHINE
Coordonnées
+86-010 612 55 400
[email protected]
[email protected]
[email protected]
-
Dr. Yu-Liang Huang
TAIPEI CHINOIS
Adresse
Veterinary Research Institute, Council of Agriculture
376 Chung-Cheng Rd, Tamsui District, New Taipei City 25158Coordonnées
+886226212111
[email protected]
Peste équine
-
Dr Baratang Alison Lubisi
AFRIQUE DU SUD
Adresse
Senior Research Veterinarian
Onderstepoort Veterinary Institute, Agricultural Research Council, Private Bag X05, Onderstepoort 0110Coordonnées
+27-12 529 91 17
[email protected]
-
Dr José Manuel Sánchez-Vizcaíno
ESPAGNE
Adresse
Centro de Vigilancia Sanitaria Veterinaria (VISAVET) Facultad de VeterinariaHCV Planta sótanoUniversidad Complutense de Madrid (UCM)
Avda Puerta de Hierro s/n, 28040 MadridCoordonnées
+34-91 394.40.82
[email protected]
-
Dr Montserrat Agüero Garcia
ESPAGNE
Adresse
Laboratorio Central de Sanidad Animal
LCV-Algete, Ctra. Algete Km 828110 Algete, MadridCoordonnées
+34 913 47 83 12
[email protected]
-
Dr. Carrie Batten
ROYAUME-UNI
Piroplasmose équine
-
Prof. Naoaki Yokoyama
JAPON
Adresse
Obihiro University of Agriculture and Veterinary Medicine Nishi 2-13, Inada-cho Obihiro, Hokkaido 080-8555 Hokkaido
Coordonnées
+81-155 49.56.49
[email protected]
Pleuropneumonie contagieuse caprine
-
Dr Lucia Manso-Silvan
FRANCE
Adresse
CIRAD Département BIOSUMR CIRAD-INRAe ASTRE : "Animal, Santé, Territoires, Risques, Ecosystèmes"
Campus International de Baillarguet TA A-117/E 34398 Montpellier Cedex 5 MONTPELLIERCoordonnées
+33 (0)4 67 59 37 39
[email protected]
-
Dr. Umit Özdemir
RÉPUBLIQUE DE TÜRKIYE
Adresse
Pandik Veterinary Control Institute
Batı mahallesi, Erol Kaya caddesi 1, 34890 İstanbulCoordonnées
+90-216 390.12.80
[email protected]
Péripneumonie contagieuse bovine
-
To Be Decided
BOTSWANA
Adresse
National Veterinary Laboratory
Private Bag 0035, GaboroneCoordonnées
+267 392 87 16
[email protected]
-
Dr Lucia Manso-Silvan
FRANCE
Adresse
CIRAD Département BIOSUMR CIRAD-INRAe ASTRE : "Animal, Santé, Territoires, Risques, Ecosystèmes"
Campus International de Baillarguet TA A-117/E 34398 Montpellier Cedex 5 MONTPELLIERCoordonnées
+33 (0)4 67 59 37 39
[email protected]
-
Dr Massimo Scacchia
ITALIE
Adresse
Istituto Zooprofilattico Sperimentaledell'Abruzzo e del Molise 'G. Caporale'
Via Campo Boario 64100 Teramo TERAMOCoordonnées
+390-861 33 24 05
[email protected]
-
Dr Ana Rosa Pombo Botelho
PORTUGAL
Adresse
Instituto Nacional de Investigação Agrária e Veterinária (INIAV, IP)
Av. da República, Quinta do Marquês, s/n 2780-157 Oeiras OEIRASCoordonnées
+351-21 440 35 14
[email protected]
Rage
-
Dr Claude Taurai Sabeta
AFRIQUE DU SUD
Adresse
Rabies Unit
Onderstepoort Veterinary Institute, Agricultural Research Council, Private Bag X05, Onderstepoort 0110Coordonnées
+27-12 529 94 39
[email protected]
-
Dr Thomas Müller
ALLEMAGNE
Adresse
Institute of Molecular Virology and Cell Biology, Friedrich-Loeffler Institut,Federal Research Institute for Animal Health
Südufer 10 D-17493 Greifswald – Insel Riems GreifswaldCoordonnées
+49-38351 7 1659
[email protected]
-
Dr. Christine Fehlner-Gardiner
CANADA
Adresse
Centre of Expertise for Rabies CFIA/ACIA, Ottawa Laboratory Fallowfield, Animal Diseases Research Institute
3851 Fallowfield Road, P.O. Box 11300, Station H, Nepean, Ontario K2H 8P9Coordonnées
+1-343 212 03 04
[email protected]
-
Dr Dong-Kun Yang
CORÉE (RÉP. DE)
Adresse
Animal and Plant Quarantine Agency
177 Hyeoksin 8-ro Gimcheong-si Gyeongsangbuk-do 39660 GyeongsangbukCoordonnées
+82 31 467.1783
[email protected]
-
Dr Florence Cliquet
FRANCE
Adresse
ANSES (French Agency for Food, Environmental and Occupational Health & Safety)
Laboratory for Rabies and Wildlife (Nancy), Technopôle agricole et vétérinaire Domaine de Pixérécourt, B.P. 40009, 54220 Malzéville CedexCoordonnées
+33 (0)3 83 29 89 50
[email protected]
-
Dr Shrikrishna Isloor
INDE
Adresse
OIE Twinned KVAFSU-CVA Rabies Diagnostic Laboratory, Department of Microbiology, Veterinary College
Karnataka Veterinary, Animal and Fisheries Sciences University (KVAFSU), Hebbal, Bangalore 560024,Coordonnées
+91-80 29.53.22.87
[email protected]
-
Dr Boris Yakobson
ISRAËL
Adresse
Kimron Veterinary Institute
Veterinary Services and Animal Health, P.O. Box 12, Beit Dagan 50250Coordonnées
+ 972-3 9681720
[email protected]
-
Dr. Juan Antonio Montaño Hirose
MEXIQUE
Adresse
Centro Nacional de Servicios de Diagnóstico en Salud Animal
Av. Centenario de la Educación s/n (Km 37.5 Carretera Federal México – Pachuca) 55740 Tecámac de Felipe Villanueva Tecámac, Estado de México TecámacCoordonnées
+525559051000
[email protected]
[email protected]
-
Dr Vlad Vuta
ROUMANIE
Adresse
National Reference Laboratory for Rabies, Institute for Diagnosis and Animal Health
Dr Nicolae Staicovici Street, No. 63, Sector 5, Bucharest 050557Coordonnées
+40-374 32.20.00
[email protected]
[email protected]
-
Dr Anthony Fooks
ROYAUME-UNI
Adresse
Animal and Plant Health Agency
New Haw, Addlestone, Weybridge, Surrey KT15 3NBCoordonnées
+44-208 415.22.38
[email protected]
-
Prof. Changchun Tu
RÉPUBLIQUE POPULAIRE DE CHINE
-
Dr. Ryan Wallace
ÉTATS-UNIS D'AMÉRIQUE
Adresse
Poxvirus and Rabies Branch, Division of High-Consequence Pathogens and Pathology
National Center for Emerging and Zoonotic Infectious Diseases, Centers for Disease Control and Prevention, 1600 Clifton Road, NE, Mail Stop G33, Atlanta, GA 30 333Coordonnées
+1-404 639.10.50
[email protected]
Rhinopneumonie équine
-
Prof. Ann Cullinane
IRLANDE
Adresse
Irish Equine Centre
Johnstown, Naas, Co. KildareCoordonnées
+353-45 86.62.66
[email protected]
-
Dr. Lutz Goehring
ÉTATS-UNIS D'AMÉRIQUE
Rhinotrachéite infectieuse bovine/vulvovaginite pustuleuse infectieuse
-
Dr. Martin Beer
ALLEMAGNE
Adresse
Institute of Diagnostic VirologyFriedrich-Loeffler Institut,Federal Research Institute for Animal Health
Südufer 10 D-17493 Greifswald, Insel RiemsCoordonnées
+49 38351 7 1223
[email protected]
[email protected]
-
Dr Akbar Dastjerdi
ROYAUME-UNI
Adresse
Animal and Plant Health Agency
New Haw, Addlestone, Weybridge, Surrey KT15 3NBCoordonnées
+44-1932 35.75.08
[email protected]
Rhinotraéchite de la dinde
-
Dr Nicolas Eterradossi
FRANCE
Adresse
ANSES (French Agency for Food, Environmental and Occupational Health & Safety)
Ploufragan-Plouzané-Niort Laboratory, Poultry and Rabbit Virology, Immunology, Parasitology Unit, B.P. 53, 22440 PloufraganCoordonnées
+33 (0)2 96 01 62 22
[email protected]
Résistance microbienne
-
Dr Chris Teale
ROYAUME-UNI
Adresse
Animal and Plant Health Agency
New Haw, Addlestone, Weybridge, Surrey KT15 3NBCoordonnées
+44-1743 46 76 21
[email protected]
Salmonelloses
-
Dr Istvan Szabo
ALLEMAGNE
Adresse
Federal Institute for Risk Assessment
Diedersdorfer Weg 1 D-12277 Berlin BERLINCoordonnées
+49-30 184 12 22 20
[email protected]
-
Dr. Gitanjali Arya
CANADA
Adresse
The Guelph Reference Services Unit, The National Microbiology Laboratory at Guelph
Public Health Agency of Canada, 110 Stone Road West, Guelph, ON N1G 3W4Coordonnées
+1-519 826.26.40
[email protected]
-
Dr Min-Su Kang
CORÉE (RÉP. DE)
Adresse
Avian Bacteriology LaboratoryAvian Disease Research Division
Animal and Plant Quarantine Agency (APQA) Ministry of Agriculture, Food and Rural Affairs (MAFRA) 177, Hyeoksin 8-ro Gimcheon-si Gyeongsangbuk-do, 39660, Gimcheon-siCoordonnées
+82-54 912 08 18
[email protected]
-
Dr. Antonia Ricci
ITALIE
Adresse
Istituto Zooprofilattico Sperimentale delle Venezie, National Reference Laboratory for Salmonella
Viale dell'Università, 10,35020 Legnaro (Padova), LegnaroCoordonnées
+39-049 8084.296
[email protected]
-
Dr. Francesca Martelli
ROYAUME-UNI
Adresse
Animal and Plant Health Agency
New Haw, Addlestone, Weybridge, Surrey KT15 3NBCoordonnées
+44-1932 35 73 61
[email protected]
Stomatite vésiculeuse
-
Dr Edviges Maristela Pituco
BRÉSIL
Adresse
PANAFTOSA
Av. President Kennedy 7778 25040-000 Duque de Caxias Rio de Janeiro Rio de JaneiroCoordonnées
+55-21 36.61.90.64
[email protected]
-
Dr. Rachel Tell
ÉTATS-UNIS D'AMÉRIQUE
Adresse
National Veterinary Services Laboratories, USDA, APHIS, VS
1920 Dayton Avenue, Ames, Iowa 50010Coordonnées
+15153377551
[email protected]
Streptococcie porcine
-
Prof. Chengping Lu
RÉPUBLIQUE POPULAIRE DE CHINE
Adresse
Nanjing Agricultural University (NAU)
Branch of Swine Streptococcosis Diagnostic Laboratory (BSSDL), Weigang No.1, Nanjing, Jiangsu ProvinceCoordonnées
+86-25 84.39.53.28
[email protected]
[email protected]
Surra (Trypanosoma evansi)
-
Dr. Nick Van Reet
BELGIQUE
Adresse
Institute of Tropical Medicine AntwerpDepartment of Parasitology
Nationalestraat 155B-2000 AntwerpenCoordonnées
+32-3 247.63.71
[email protected]
-
Prof. Noboru Inoue
JAPON
Adresse
National Research Center for Protozoan DiseasesObihiro University of Agricultureand Veterinary Medicine
Inada-cho Nishi 2-13 Obihiro, Hokkaido 080-8555 HokkaidoCoordonnées
+81-155 49.56.47
[email protected]
Syndrome dysgénésique et respiratoire du porc
-
Dr Katarzyna Podgórska
POLOGNE
Adresse
National Veterinary Research Institute
Partyzantow Str. 57 24-100 Pulawy PULAWYCoordonnées
+48-81 889 30 47
[email protected]
[email protected]
-
Dr Kegong Tian
RÉPUBLIQUE POPULAIRE DE CHINE
Adresse
Veterinary Diagnostic LaboratoryChina Animal Disease Control Center
No.17 Tiangui Street Biomedical Base Daxing District Beijing 102618 BeijingCoordonnées
+86-10 59.19.88.96
[email protected]
[email protected]
Syndrome respiratoire du Moyen-Orient
-
Prof. Ulrich Wernery
ÉMIRATS ARABES UNIS
Adresse
Central Veterinary Research Laboratory
P.O. Box 597 Dubai DubaiCoordonnées
+971-4 337.51.65
[email protected]
Theilériose
-
To Be Decided
ITALIE
Adresse
Istituto Zooprofilattico Sperimentale della Sicilia (IZSSi),
Italian Reference Centre for Anaplasma, Babesia, Rickettsia, Theileria (C.R.A.Ba.R.T.), via Gino Marinuzzi 3, 90129, PalermoCoordonnées
+39-091 656.53.41 ext 219
[email protected]
Theilériose ovine
-
Prof. Hong Yin
RÉPUBLIQUE POPULAIRE DE CHINE
Adresse
Lanzhou Veterinary Research Institute, Chinese Academy of Agricultural Sciences(CAAS)
Vector and Vector and Vector-borne Diseases Control Laboratory (VVBDC), Xujiaping 1, Chengguan District, Lanzhou, Gansu Province 730046Coordonnées
+86-93 18.34.26.81
[email protected]
Tremblante
-
Dr. Gordon Mitchell
CANADA
Adresse
Canadian Food Inspection Agency, Ottawa Laboratory (Fallowfield), Animal Disease Research Institute
3851 Fallowfield Road, P.O. Box 11300, Station H, Nepean, Ontario K2H 8P9nCoordonnées
+1-613 221.48.54
[email protected]
-
Dr Juan José Badiola Díez
ESPAGNE
Adresse
Centro de investigación en Encefalopatías y enfermedades transmisibles emergentes
Universidad de Zaragoza, Facultad de Veterinaria, Departamento de Patología Animal, Miguel Servet 177, 50013 ZaragozaCoordonnées
+34-976 76 20 19
[email protected]
-
Dr Cristina Casalone
ITALIE
Adresse
Italian National Reference Centre for Diagnostic Activities in Stranded Marine Mammals (C.Re.Di.Ma.), via Bologna 148, 10154 TorinoCoordonnées
+39-11 26 86 296
[email protected]
[email protected]
-
Dr John Spiropoulos
ROYAUME-UNI
Adresse
Animal and Plant Health Agency
New Haw, Addlestone, Weybridge, Surrey KT15 3NBCoordonnées
+44 1932 357.564
[email protected]
-
Prof. Torsten Seuberlich
SUISSE
Adresse
Neuro Centre Department of Clinical Research and Veterinary Public Health
Division of Experimental Clinical Research, University of Bern, Bremgartenstrasse 109 A3012 Bern,Coordonnées
+41-31 631 22 06
[email protected]
Trichinellose
-
Dr Brad Scandrett
CANADA
Adresse
Canadian Food Inspection Agency 116 Veterinary Road Saskatoon Saskatchewan S7N 2R3 Saskatoon
Coordonnées
+1-306 385.78.18
[email protected]
-
Dr. Maria Angeles Gomez Morales
ITALIE
Adresse
Istituto Superiore di Sanita, Laboratorio di Parasitoligia
Viale Regina Elena 299, 00161 RomaCoordonnées
+390-6 49.90.23.04
[email protected]
Trypanosomose (transmise par tsé-tsé)
-
Dr Marc Desquesnes
FRANCE
Adresse
UMR177-Intertryp (CIRAD-IRD)CIRAD-bios
Campus international de Baillarguet TA A-17 / G 34398 Montpellier Cedex 5 MontpellierCoordonnées
+33-(0)4 67 59 37 24
[email protected]
Tuberculose chez les mammifères
-
Dr Bernardo Alonso
ARGENTINE
Adresse
DILAB (Dirección de Laboratorios y Control Técnico) Servicio Nacional de Sanidad y Calidad, Agroalimentaria (SENASA)
Talcahuano 1660,1640 Martínez, Prov. de Buenos AiresCoordonnées
+54-11 48.74.67.35
[email protected]
[email protected]
-
Dra. Beatriz ROMERO MARTINEZ
ESPAGNE
Coordonnées
+34913944033
[email protected]
[email protected]
-
Dr María Laura Boschiroli-Cara
FRANCE
Adresse
ANSES (French Agency for Food, Environmental and Occupational Health & Safety)
Animal Health Laboratory (Maisons-Alfort), Bacterial Zoonoses Unit, 14 rue Pierre et Marie Curie, 94701 Maisons-Alfort CedexCoordonnées
+330149771350
[email protected]
-
Dr Jason Sawyer
ROYAUME-UNI
Adresse
Animal and Plant Health Agency
New Haw, Addlestone, Weybridge, Surrey KT15 3NBCoordonnées
+44-1932 34.11.11
[email protected]
-
Dr. Tyler C. Thacker
ÉTATS-UNIS D'AMÉRIQUE
Variole du chameau
-
Prof. Ulrich Wernery
ÉMIRATS ARABES UNIS
Adresse
Central Veterinary Research Laboratory
P.O. Box 597 Dubai DubaiCoordonnées
+971-4 337.51.65
[email protected]
Varroose (infestation des abeilles mellifères par Varroa spp.)
-
Dr Marc O. Schäfer
ALLEMAGNE
Adresse
National Reference Laboratory for Bee Diseases, Friedrich-Loeffer-Institut
Federal Research Institute for Animal Health, Institute of Infectology, Südufer 1017493 Greifswald – Insel RiemsCoordonnées
+49-38351 7 1246
[email protected]
-
Dr Marie-Pierre Chauzat
FRANCE
Adresse
ANSES (French Agency for Food, Environmental and Occupational Health & Safety)
Sophia Antipolis Laboratory, Honey Bee Pathology Unit, Les Templiers 105 route des Chappes, CS 20111, 06902 Sophia AntipolisCoordonnées
+33 (0)4 92 94 37 00
[email protected]
-
Dr. Richard J. Hall
NOUVELLE-ZÉLANDE
Coordonnées
+6448945600
[email protected]
Virus iridescent des décapodes 1
-
Dr. Chien Tu
TAIPEI CHINOIS
Contrôle des compétences d’un laboratoire
1. Introduction
1.1. Objet
Ce document contient des lignes directrices applicables à l’évaluation des capacités d’un laboratoire vétérinaire en matière de diagnostic des maladies infectieuses.
1.2. Champ d’application
Ces lignes directrices sont destinées aux Pays Membres de l’OMSA qui souhaitent évaluer les laboratoires procédant à l’examen des animaux et des produits d’origine animale destinés aux échanges internationaux. Ces lignes directrices doivent être utilisées avec les Lignes directrices de l’OMSA pour l’évaluation de la qualité des laboratoires qui permettent de réaliser une appréciation globale de la qualité et des capacités des laboratoires.
Ce guide respecte les exigences stipulées dans la série de normes ISO[1] 9000, la norme l’ISO/IEC[2]17025 et le Guide ISO 43.
1.3. Comparaisons interlaboratoires
Des comparaisons interlaboratoires peuvent être effectuées pour différentes raisons dans le but :
i) d’évaluer l’aptitude d’un laboratoire à réaliser des épreuves diagnostiques spécifiques,
ii) de contrôler ou certifier la compétence d’un agent de laboratoire en particulier,
iii) de contrôler ou certifier l’étalonnage des instruments,
iv) d’harmoniser les méthodes d’analyse existantes,
v) d’évaluer les nouvelles méthodes d’analyse,
vi) d’assigner des valeurs et des limites aux matériels étalons,
vii) de remédier aux écarts constatés d’un laboratoire à l’autre.
1.4. Contrôle des compétences
Lorsqu’une comparaison interlaboratoire est réalisée expressément dans le but d’évaluer la capacité d’un laboratoire à réaliser des épreuves diagnostiques spécifiques (1.3 (i) ci-dessus), il s’agit d’un contrôle de compétence. Le contrôle de compétence fait partie intégrante de la plupart des programmes d’accréditation des laboratoires.
Les contrôles de compétence sont réalisés en utilisant des ensembles définis de matériels à tester, parfaitement caractérisés, parfois appelés séries d’échantillons de contrôle. Ces séries sont soumises simultanément à tous les laboratoires participants. Les résultats sont recueillis et analysés comparativement au résultat attendu dans le but de déterminer l’aptitude d’un laboratoire à réaliser une épreuve diagnostique et à fournir des résultats corrects.
1.5. Accréditation d’un laboratoire
Un programme d’accréditation est une procédure formelle par laquelle un organisme indépendant reconnaît la qualité et les capacités d’un laboratoire. Pour conserver son statut, un laboratoire doit participer à ce programme de manière permanente et obtenir les résultats souhaités. L’organisme accorde ou refuse ce statut en fonction des exigences stipulées de qualité et de capacité.
Au stade initial de la accréditation, le laboratoire doit prouver qu’il respecte un niveau de qualité défini et constant. Dans les conditions idéales, pour pouvoir participer au programme, un laboratoire doit avoir des procédures de travail conformes à l’ISO 9000 et à l’ISO/IEC 17025 intitulé « General Requirements for the Competence of Calibration and Testing Laboratories » (1990) (critères généraux de compétence des laboratoires d’étalonnage et d’essai) pour être autorisé à participer à un programme de contrôle de compétence. Il est cependant reconnu que, pour certains laboratoires, le niveau correspondant peut être difficile à atteindre pour diverses raisons. Les lignes directrices de l’OMSA pour l’évaluation de la qualité d’un laboratoire ont été préparées afin de définir un nouveau minimal de qualité.
La deuxième étape de l’accréditation comporte un contrôle des compétences programmé à intervalles réguliers visant l’évaluation de la capacité d’un laboratoire à effectuer des tests de diagnostic spécifiques. Dans la mesure où les programmes de contrôle de compétence représentent une forme de comparaison entre laboratoires, ils doivent inclure ou moins deux laboratoires. Il n’existe aucune norme reconnue pour le contrôle de compétence en matière de diagnostic vétérinaire, bien qu’il existe différentes approches au niveau national ou international. Les présentes lignes directrices ont été préparées pour être utilisées conjointement avec les lignes directrices de l’OMSA pour l’évaluation de la qualité des laboratoires. Conjuguées, ces lignes directrices représentent une base acceptable pour un programme d’assurance qualité.
2. Organisme d’accréditation et reconnaissance d’un statut
Comme pour les programmes d’accréditation, les systèmes de contrôle de compétence doivent être conduits si possible par un organisme indépendant afin d’éviter toute subjectivité dans la reconnaissance ou le refus d’un statut.
La participation à un programme international de contrôle de compétence doit être volontaire. La non participation ou la non obtention d’un statut ne doit pas interdire à un laboratoire de réaliser des tests diagnostiques ou empêcher un pays de conclure des échanges commerciaux.
L’organisme d’accréditation ne peut imposer aux partenaires commerciaux la participation à un programme et la reconnaissance d’un statut, cette procédure ne pouvant intervenir que si le laboratoire ou les autorités du pays le demandent ou y consentent.
Les laboratoires participants peuvent être amenés à participer aux frais découlant du programme.
3. Organisation et gestion
Les détails et l’objectif du programme de contrôle de compétence, les critères de participation des laboratoires et le traitement des résultats relèvent de la responsabilité de l’organisme coordinateur, afin d’assurer le respect des droits de propriété et la confidentialité des informations.
Le gestionnaire d’un programme de contrôle de compétence doit assumer la responsabilité globale du fonctionnement, de la qualité et de la sécurité de ce programme.
Il lui appartient également d’assurer que les laboratoires participant à la production des matériels à tester respectent les exigences des normes de la série ISO 9000 et de l’ISO/IEC 17025.
Le personnel ne doit subir aucune pression ou influence susceptible de peser outre mesure sur l’analyse des résultats du contrôle de compétence ou sur le statut reconnu à un laboratoire participant.
Le personnel chargé de la production et de la distribution des matériels à tester destinés à un programme de contrôle de compétence ou participant à la réception et à l’analyse des résultats soumis par les laboratoires participants doit assurer la surveillance et la sécurité nécessaires.
4. Méthodes de standardisation
La méthode de standardisation appliquée pour caractériser les matériels à tester inclus dans une série d’échantillons de contrôle doit répondre au minimum aux caractéristiques de performances diagnostiques exigées pour un test prescrit dans le Manuel des normes de l’OMSA pour les tests de diagnostic et les vaccins.
La méthode doit être établie par rapport aux produits de référence internationaux s’il en existe. Les laboratoires participants doivent aussi être incités à aligner leurs propres procédures en utilisant les mêmes étalons internationaux.
5. Sélection et composition d’une série d’échantillons de contrôle
5.1. Principes généraux
Pour sélectionner les matériels à tester à inclure dans une série d’échantillons de contrôle, l’évaluation initiale du statut et/ou de la réactivité des échantillons sera effectuée par le laboratoire producteur en utilisant la méthode standard.
Les matériels à tester acceptés pour inclusion dans une série d’échantillons doivent être soumis à des contrôles répétés, effectués par plusieurs opérateurs, et à des séries d’essais multiples réalisés à des jours différents. Le nombre de résultats obtenu doit être suffisant pour s’assurer que le matériel à tester est bien fiable, y compris en termes d’homogénéité.
5.2. Composition de l’ensemble d’évaluation
Le nombre d’échantillons à inclure dans une série d’échantillons de contrôle n’est pas bien défini et dépend du type d’analyse qui sera appliqué aux résultats et du nombre requis pour assurer la validité statistique.
Quelle que soit la nature du test, il convient d’inclure un minimum de trois échantillons :
i) un échantillon certainement et fortement positif,
ii) un échantillon certainement et faiblement positif,
iii) un échantillon certainement négatif.
Toutefois, la limitation à trois échantillons de ce type donnerait lieu à des résultats facilement prévisibles après quelques contrôles de compétence. Il apparaît donc utile d’ajouter au moins deux échantillons supplémentaires à la série, qui peut varier d’un contrôle à l’autre. Cette approche permet d’éviter que les laboratoires participants prévoient l’issue de la procédure. Les échantillons supplémentaires peuvent être différents de ceux indiqués ci-dessus, être du même type, ou faire appel à une combinaison.
Lors de la planification du processus global de préparation, d’analyse et de distribution du matériel étudié et des éléments de l’épreuve, le prestataire devra, s’il y a lieu, prévoir les procédures et les ressources en vue d’assurer ce qui suit :
i) sélection du matériel ;
ii) milieu adapté à la préparation et à l’analyse du matériel à tester ;
iii) préparation du matériel ;
iv) mesures et analyses ;
v) étalonnage/validation de l’équipement et méthodes de mesure ;
vi) évaluation de l’homogénéité du matériel soumis à l’analyse ;
vii) évaluation de la stabilité du matériel analysé ;
viii) organisation de comparaisons interlaboratoires avec les collaborateurs, le cas échéant ; (voir note 1 ci-dessous)
ix) installations et conditions appropriées de stockage ;
x) conditionnement et étiquetage appropriés ;
xi) modalités de transport et de distribution adaptées ;
xii) analyse statistique des résultats de l’épreuve et attribution des valeurs mesurées et des incertitudes associées ;
xiii) bonne qualité du service de communication des données aux participants.
6. Analyse statistique des épreuves sérologiques
6.1. Types de données
Le choix de l’analyse statistique dépendra en partie du type de données généré par la méthode d’analyse à l’étude. Les données qualitatives telles que « positif », « négatif » et/ou « suspect » ont une valeur relativement limitée pour les procédures statistiques qui peuvent s’appliquer. Les données quantitatives telles que le titre final de la réaction ou les résultats semi-quantitatifs tels que les pourcentages d’inhibition sont plus souples, compte tenu des types d’analyses statistiques possibles.
Quel que soit le type de données à analyser, il est important que les résultats émanant de tous les laboratoires participants soient compatibles. Dans certains cas, il peut être demandé aux laboratoires participants d’utiliser une série de dilutions spécifique ou d’exprimer leurs résultats par rapport à un réactif de référence conventionnel.
6.2. Valeurs conventionnelles
L’une ou l’autre des deux approches suivantes peut être utilisée :
a) Attribution d’une valeur cible avant résultat
Lors de la sélection initiale des matériels devant être inclus dans une série d’échantillons de contrôle, le laboratoire producteur aura attribué une valeur, des limites ou un statut préliminaire aux échantillons. Pour les données qualitatives, la valeur attribuée peut être la seule valeur acceptable. Dans cette hypothèse, le laboratoire producteur devra procéder à une vérification par une batterie de tests, afin de confirmer avec une plus grande certitude que la valeur assignée est correcte. Toutefois, l’objectif est qu’au moins 80% des laboratoires participants obtiennent le même résultat. Pour les données quantitatives et semi-quantitatives, la valeur assignée doit être recalculée au vu des résultats soumis par les laboratoires, en retenant la valeur moyenne après élimination des valeurs extrêmes.
b) Attribution d’une valeur cible à la valeur consensuelle des résultats rendus par les participants
6.3. Méthodes statistiques
De nombreuses méthodes statistiques ont été appliquées aux comparaisons interlaboratoires, certaines étant beaucoup plus sophistiquées que d’autres. En règle générale, la méthode utilisée doit être valide, directe et signifiante pour les laboratoires participants.
L’analyse de fréquence est une méthode simple et signifiante pour les laboratoires participants qui souhaitent situer leurs performances par rapport à celles des autres laboratoires inclus dans le programme de contrôle de compétence.
La mesure de la variance intralaboratoire et interlaboratoire par des indices de répétabilité et de reproductibilité fournit souvent des informations utiles sur la précision et la robustesse des méthodes de test.
L’analyse de Youden est un indicateur utile des sources d’erreurs systématiques ou aléatoires susceptibles de poser des problèmes dans certains laboratoires.
7. Critères de succès ou d’échec
Les critères de réussite ou d’échec d’un laboratoire à un contrôle de compétence doivent être définis par écrit. Ils doivent prendre en considération certains facteurs qui peuvent varier d’une maladie à l’autre et d’un type de test à l’autre. Une fois établis, ces critères doivent être appliqués de manière uniforme.
Les types d’analyses statistiques retenus doivent faciliter la prise de décision sur l’issue du contrôle. Les laboratoires qui soumettent des résultats sortant des limites établies par des moyens statistiques doivent être identifiés. Les données des tests sérologiques susceptibles de donner lieu à un résultat faussement négatif pour un animal infecté doivent être pondérées par rapport à celles qui risquent de donner lieu à un résultat faussement positif pour un animal non atteint. Dans la plupart des cas, le premier type d’erreur ne doit pas être toléré car il indique un problème de sensibilité diagnostique. Une certaine marge de manoeuvre peut cependant être accordée pour la reconnaissance d’un statut provisoire aux laboratoires confrontés à des problèmes de spécificité diagnostique.
8. Fréquence des contrôles de compétence
Il est recommandé d’exercer un contrôle de compétence deux fois par an. Selon le pays et la maladie concernés, il convient de prendre en compte les périodes d’activité analytique maxima. Si possible, au moins l’un des tests de compétence devrait coïncider avec les périodes de forte activité.
Le renouvellement des contrôles de compétence à six mois d’intervalle assure un délai suffisant pour prendre les mesures de correction qui s’imposent et éviter au laboratoire de perdre son statut.
9. Reconnaissance d’un statut
Les critères d’attribution, de refus ou de retrait d’un statut doivent être clairement définis.
10. Logistique
10.1. Acceptation du programme
Le plan de contrôle de compétence doit être présenté dans sa globalité aux laboratoires répondant aux critères de participation. Cette présentation doit comporter des détails sur la fréquence des contrôles, les engagements et les délais, les méthodes d’analyse des données, l’envoi des conclusions, les critères de reconnaissance d’un statut, le traitement des résultats et la confidentialité. De plus, un formulaire à signer et à retourner à l’organisme coordinateur doit être inclus pour indiquer que le laboratoire accepte les conditions du programme.
10.2. Notification du contrôle et envoi des séries d’échantillons
Les laboratoires participants doivent être prévenus au moins un mois à l’avance de l’exécution d’un contrôle de compétence convenu. Cette notification doit indiquer la date prévue et la méthode d’expédition des séries d’échantillons. Le délai de notification peut être plus long pour les laboratoires situés dans des pays où une autorisation est nécessaire pour importer les séries d’échantillons.
Les matériels à tester inclus dans une série d’échantillons de contrôle doivent être codés de manière à ne pas dévoiler le résultat attendu. Ce codage peut être alphabétique ou numérique. Chaque laboratoire participant doit recevoir une série d’échantillons correspondant à un ensemble de codes unique, afin d’éviter toute entente entre laboratoires.
Tous les échantillons doivent être expédiés par la méthode la plus rapide et la plus directe possible. Toutes les expéditions doivent respecter les réglementations de l’IATA[3] relatives à l’envoi de matériels biologiques.
Après l’expédition, les laboratoires destinataires doivent recevoir les renseignements utiles (méthode d’expédition, transporteur, lettre de voiture, etc.) qui leur faciliteront le retrait du matériel et les formalités administratives à réception.
Les séries d’échantillons arrivées détériorés ou dans un état douteux doivent être immédiatement remplacées.
10.3. Réalisation des tests et retour des résultats
Les laboratoires participants doivent recevoir le matériel à tester dans un volume suffisant. Les délais accordés doivent leur permettre d’analyser la série d’échantillons comme ils l’entendent. Ces échantillons peuvent être analysés à plusieurs reprises et par plusieurs agents du laboratoire. Une seule série de résultats doit cependant être retournée à l’organisme coordinateur. En principe, c’est la personne habituellement chargée de réaliser les essais en routine qui doit être choisie pour traiter la série d’échantillons de contrôle.
La série d’échantillons de contrôle doit être accompagnée d’un jeu complet d’instructions relatives à la reconstitution, à la conservation, à la manipulation, aux contraintes spécifiques, à l’expression des données et aux délais à respecter pour l’envoi des résultats.
Les résultats doivent être retournés sous le format et dans les délais voulus. À défaut, le laboratoire pourrait être exclu du contrôle et perdre son statut ou le voir modifier.
L’organisme coordinateur doit accuser réception des résultats, en précisant si ceux-ci sont recevables pour l’analyse.
10.4. Analyse des résultats et rapport
L’analyse des résultats et le rapport de cette analyse doivent être faits dans des délais impartis.
Un rapport général récapitulant les résultats de toutes les analyses doit être préparé pour distribution à tous les laboratoires participants. Un code doit être attribué aléatoirement à tous les laboratoires participants pour assurer leur anonymat dans le texte du rapport général. Les laboratoires doivent être informés du code qu’ils ont reçu spécifiquement pour un plan de contrôle donné.
Les laboratoires doivent aussi recevoir un résumé relatif à leurs propres performances et avoir connaissance du statut qui leur est reconnu. Ce résumé doit indiquer clairement tous les facteurs ayant contribué à une modification éventuelle du statut antérieur. En cas d’attribution d’un statut inférieur, il est particulièrement important de faire connaître les causes réelles ou potentielles ayant motivé la décision. Dans certains cas, il peut être utile de soumettre au laboratoire une seconde série d’échantillons identiques, une fois que les mesures de correction nécessaires ont été prises.
La reconnaissance du statut peut aussi se faire sous forme d’une accréditation officielle.
Les données, les analyses effectuées et le statut reconnu aux laboratoires participants doivent toujours rester entièrement confidentiels.
11. Publication des informations
Le principal objectif de ces lignes directrices est de supprimer les barrières commerciales et non d’en créer. On peut s’attendre à ce que les laboratoires dont le statut a été reconnu demandent qu’une vérification officielle de ce statut soit proposée aux partenaires commerciaux par l’organisme indépendant ou le coordinateur. Cette démarche ne doit être entreprise qu’à la demande ou avec le consentement du laboratoire ou des autorités du pays concerné.
12. References
ISO/IEC International Standard 17025 (2005). General requirements for the competence of testing and calibration laboratories. International Organisation for Standardisation (ISO)/International Electrotechnical Commission (ISO/IEC), ISO Central Secretariat, 1 rue de Varembé, Case Postale 56, CH – 1211, Geneva 20, Switzerland.
International Organisation for Standardisation (ISO) (1997). Proficiency testing by interlaboratory comparisons. Part 1: Development and operation of proficiency testing schemes. Part 2: Selection and use of proficiency testing schemes by laboratory accreditation bodies. ISO/International Electrotechnical Commission (ISO/IEC), Guide 43. ISO/IEC, Geneva, 19 pp.
ISO International Standards 9000:2005, 9001:2000; 9004:2000 (2000–2005). Quality management and quality assurance. International Organization for Standardization (ISO), ISO Central Secretariat, 1 rue de Varembé, Case Postale 56, CH – 1211, Geneva 20, Switzerland.
[1] ISO : Organisation internationale de normalisation
[2] IEC : Commission électrotechnique internationale
[3] IATA : Association internationale de transport aérien
Critères
Critères de sélection des établissements pouvant prétendre au statut de Centre de référence de l’OMSA :
- aptitude, capacité et détermination à fournir les services décrits dans le mandat des Centres de référence de l’OMSA, qui constituent la base des relations avec l’Organisation, notamment la capacité à recevoir des spécimens biologiques provenant d’autres États Membres de l’OMSA ;
- renommée scientifique et technique au niveau national et international, présence d’experts vétérinaires dans les équipes scientifiques et, pour les Laboratoires de référence, conformité aux normes internationales de l’OMSA et aux autres normes sur l’assurance qualité des laboratoires et les mesures de biosécurité ;
- place de l’établissement dans les structures sanitaires, scientifiques ou éducatives de l’État Membre ;
- qualité du leadership scientifique et technique de l’établissement, et plus particulièrement reconnaissance internationale dans son domaine de compétence ; et pour les Centres collaborateurs, nombre de collaborateurs et qualifications de ceux-ci ;
- stabilité prospective de l’établissement en termes de personnel, d’activité et de financement ;
- relations de travail développées par l’établissement du États membre aux niveaux national, régional et mondial ;
- importance technique et géographique de l’établissement et de ses activités par rapport aux priorités d’action de l’OMSA.
Réglement intérieur
ARTICLE 1
Les candidatures au titre de Centre de référence de l’Organisation mondiale de la santé animale (OMSA) doivent être adressées au Directeur général par le Délégué de l’État Membre de l’OMSA dont relève l’établissement ou par la Commission régionale correspondante.
ARTICLE 2
Le directeur de l’établissement fournit au Directeur général une déclaration au nom de l’établissement et de son personnel pour couvrir les conflits d’intérêt potentiels entre l’établissement, en tant que centre de l’OMSA, et de structure commerciale quelle qu’elle soit, selon une procédure établie par le Directeur général. Le responsable de l’établissement doit s’engager à ce que l’institution et le personnel respectent la confidentialité qui s’attache aux informations qu’ils ont à connaitre dans l’exercice de leurs fonctions pour l’OMSA et il remet un engagement de confidentialité au Directeur général.
Un laboratoire de référence doit respecter les droits de propriété intellectuelle applicables aux échantillons reçus et ne doit pas utiliser les résultats, sans consentement, pour poursuivre au-delà de la détermination des principales caractéristiques de l’agent pathogène nécessaires pour procéder aux enquêtes épidémiologiques et pour décider de la stratégie de son contrôle. En cas de résultat positif pour une maladie notifiable à l’OMSA, le laboratoire de référence doit en informer immédiatement le Délégué de l’État Membre de l’OMSA dont proviennent les échantillons, ainsi que le Siège de l’OMSA.
ARTICLE 3
Les candidatures reçues sont présentées au Conseil par le Directeur général pour approbation, après consultation de la Commission régionale et des Commissions spécialisées concernées. Les candidatures sont sélectionnées sur la base des critères spécifiés ci-dessus. Toutefois, en principe, pas plus d’un laboratoire de référence ne peut être désigné pour le même agent pathogène ou la même maladie dans un même pays, et pas plus d’un centre collaborateur ne peut être désigné pour le même domaine ou la même spécialité au sein d’une région ou, à titre exceptionnel, d’une sous-région.
ARTICLE 4
Les candidatures approuvées par le Conseil sont présentées à l’approbation de l’Assemblée.
ARTICLE 5
Le Directeur général informe les établissements approuvés de leur nomination en tant que Centres de référence de l’OMSA, avec le titre formel à utiliser en tant que Centre de référence de l’OMSA. Le Directeur général en informe également les Délégués permanents des États Membres concernés.
ARTICLE 6
Cette notification entraîne le droit pour l’établissement d’utiliser le titre de « Laboratoire de référence de l’OMSA » ou « Centre collaborateur de l’OMSA » et d’apposer le logo de l’OMSA sur tous les documents établis ès qualité, ainsi que le droit de porter, pour les Laboratoires de référence, le titre d’expert de l’OMSA pour le spécialiste désigné.
ARTICLE 7
Le Directeur du Centre de référence doit être responsable de l’entièreté de la mise en œuvre du mandat, et pour les Centres collaborateurs, doit être l’interface unique de l’OMSA. Pour un Laboratoire de référence, l’expert de l’OMSA est responsable de la mise en œuvre des aspects techniques du mandat et peut déléguer certaines responsabilités spécifiques à d’autres experts sur une base ad hoc. Les experts attachés à des Centres de référence de l’OMSA exercent leurs fonctions dans le cadre du Règlement applicable aux experts de l’OMSA.
ARTICLE 8
Les Centres de référence de l’OMSA s’engagent à fournir au Directeur général un rapport synthétique des activités liées à leur mission au terme de chaque année civile selon un modèle fourni par le siège de l’OMSA. Ce rapport est diffusé à tous les États Membres de l’OMSA.
ARTICLE 9
Un Centre de référence peut être révoqué à tout moment. Sa désignation doit être retirée si le Centre de référence ne se conforme pas aux dispositions du mandat définies du présent Réglement. Dans ce cas, le Directeur général de l’OMSA, après consultation de la Commission spécialisée appropriée, propose la révocation à l’Assemblée.
ARTICLE 10
Toute modification importante intervenant au sein de l’établissement et susceptible de réduire la compétence du Centre de référence (notamment des modifications des personnels ou dans les ressources matérielles ou financières) doit être immédiatement signalée au Directeur général qui consulte alors la Commission régionale et les Commissions spécialisées concernées sur le maintien du statut de l’établissement comme centre de référence.
Les Laboratoires de référence de l’OMSA doivent apporter des éléments probants démontrant leur leadership scientifique et leur capacité à remplir leur mandat : tous les candidats doivent idéalement être des Laboratoires de référence nationaux ; ils doivent être en mesure de recevoir les échantillons soumis par d’autres Pays membres pour être analysés à des fins de diagnostic ; ils doivent prouver leur volonté et leur capacité à participer à des essais d’aptitude interlaboratoires, mais aussi à en organiser eux-mêmes ; ils doivent être en mesure d’offrir des services de diagnostic de confirmation, des réactifs de référence, des formations, etc., à l’échelle internationale ; l’expert désigné doit avoir récemment publié de nombreux articles dans des revues à comité de lecture. Le fonctionnement d’un Laboratoire de référence nécessite la contribution d’experts dans plusieurs domaines différents travaillant sur la même maladie ou le même agent pathogène. Il est entendu que l’expert désigné par l’OMSA est un membre principal d’une telle équipe pluridisciplinaire qui pourrait consulter d’autres membres de cette équipe ayant une expertise différente en réponse aux demandes reçues, tout en restant le point de contact unique pour toute correspondance avec les Membres de l’OMSA et autres. L’article 7 du Règlement intérieur des Centres de référence de l’OMSA retranscrit cette idée lorsqu’il stipule que « Pour un Laboratoire de référence, l’expert de l’OMSA est responsable de la mise en œuvre des aspects techniques du mandat et peut déléguer certaines responsabilités spécifiques à d’autres experts sur une base ad hoc. »
Les candidatures doivent être présentées 45 jours avant la date programmée pour la réunion de la Commission spécialisée compétente (la Commission des normes biologiques ainsi que la Commission des normes sanitaires pour les animaux aquatiques se réunissent en février et septembre ; le délais sont donc mi-décembre et mi-juillet. Cette période de 45 jours laisse suffisamment de temps à l’OMSA pour sélectionner, traduire en anglais s’il y a lieu, et traiter les dossiers qui seront évalués par la Commission. Ces échéances doivent être respectées afin de permettre une évaluation exhaustive des dossiers par les membres de la Commission avant sa réunion. Les candidatures reçues hors délai seront examinées par la Commission lors de sa réunion suivante.
Les demandes doivent être présentées conformément aux dispositions de l’article 1 du Règlement intérieur et doivent contenir les informations suivantes :
Administration et gestion
1. Nom de l’expert (curriculum vitae en utilisant ce modèle).
2. Nom et adresse du laboratoire (numéro de téléphone et adresse électronique [numéro de télécopie ou site Internet, le cas échéant).
3. Nom du responsable du laboratoire (Chef de laboratoire).
4. Décrire les dispositions légales et budgétaires pertinentes mises en place pour garantir la pérennité et le bon fonctionnement du laboratoire.
5. Fournir des éléments justificatifs (certificats) de l’octroi de l’accréditation ISO 17025 ou d’une norme équivalente de gestion de la qualité, en précisant, dans l’idéal, les tests couverts par l’accréditation.
Compétences techniques et expérience
6. Donner un aperçu de l’expertise disponible dans l’équipe multidisciplinaire liée à la maladie ou à l’agent pathogène dans laquelle l’expert travaille : disciplines, nombre d’experts dans chaque discipline, niveau d’expertise.
7. Détailler l’expérience nationale et internationale dans la réalisation d’épreuves de diagnostic relevant des normes de l’OMSA pour la maladie considérée (indiquer le nombre approximatif d’épreuves réalisées annuellement pour chaque technique).
8. Fournir des informations complémentaires sur les compétences en matière de techniques diagnostiques (techniques de caractérisation de l’agent de la maladie, techniques moléculaires, techniques d’anticorps monoclonaux, etc.), d’épidémiologie et de lutte contre la maladie.
9. Détailler l’expérience dans la normalisation et la validation des épreuves de diagnostic.
10. Montrer la capacité de production de réactifs (indiquer le détail des stocks actuels de réactifs pour la maladie).
11. Montrer la capacité de réception et d’expédition internationales de prélèvements en temps voulu conformément aux spécifications en matière de transport et d’emballage exposées dans le Manuel des tests de diagnostic et des vaccins pour les animaux terrestres ainsi que dans le Code sanitaire pour les animaux terrestres et le Code sanitaire pour les animaux aquatiques de l’OMSA.
12. Fournir la liste des projets de recherche et de mise au point de méthodes appliquées à la maladie.
13. Fournir la liste des essais d’aptitude interlaboratoires que le laboratoire organise et auxquels il participe régulièrement.
14. Détailler les activités de formation et de conseil sur la maladie réalisées au cours des deux années écoulées (cours proposés, nombre de personnes formées, exemples de consultations internationales).
15. Fournir la liste des réunions scientifiques organisées par le laboratoire ainsi que celles auxquelles il a participé.
16. Fournir la liste des contributions du laboratoire à l’élaboration ou à la révision de documents de référence (chapitres pour le Manuel des tests de diagnostic et des vaccins pour les animaux terrestres, Manuel des tests de diagnostic pour les animaux aquatiques, etc.).
Collaborations, confidentialité et conflits d’intérêt
17. Fournir la liste des collaborations avec d’autres laboratoires, centres ou organisations.
18. Donner des garanties quant au respect par le personnel du caractère confidentiel de certains sujets, résultats ou communications ainsi que sur la gestion d’éventuels conflits d’intérêt au moyen de déclarations dûment remplies et signées.
19. Fournir un engagement de confidentialité et un formulaire de déclaration d’intérêts signés par le chef de l’institution au nom de l’institution, conformément aux règles applicables aux laboratoires de référence de l’OMSA.
Le traitement par l’OMSA des candidatures reçues se fera conformément aux dispositions des articles 2, 3 et 4 du Règlement intérieur.
Le dossier doit comporter un résumé succinct (d’une page maximum) des activités présentant un intérêt pour la désignation de Laboratoire de référence de l’OMSA.
Le dossier doit renseigner l’ensemble des points listés ci-dessus, en 15 à 20 pages maximum de format A4, présentées en interligne simple en utilisant la police Times New Roman de taille 10 pour le corps du texte. Les candidatures doivent être rédigées dans l’une des langues officielles de l’OMSA (français, anglais ou espagnol).
Informations relatives au traitement des données personnelles
L’OMSA, en tant que responsable du traitement de données, traitera vos coordonnées et informations d’identification obtenues auprès de sources privées pour l’exécution de son mandat, y compris pour les communications, la gestion de réunions et la formation. En outre, lors de la publication des listes des Centres de référence de l’OMSA désignés et des rapports annuels de leurs activités, l’OMSA inclura vos données personnelles sur le site Internet de l’OMSA. Les données collectées feront l’objet d’un traitement interne aux fins susmentionnées. De plus, en tant qu’organisation internationale, nous transférons des données personnelles au sein de nos différents bureaux ainsi qu’à des prestataires de services et partenaires tiers pour effectuer des tâches en notre nom et pour nous aider dans l’accomplissement de notre mandat. Vos données personnelles seront conservées jusqu’à ce qu’elles ne soient plus pertinentes. Vous disposez des droits d’accès et de rectification de vos données personnelles, ainsi que de demande d’effacement, d’opposition au traitement et d’obtention de la portabilité des données dans certaines circonstances. Vous trouverez de plus amples informations concernant le traitement et vos droits dans notre Politique de confidentialité.
Dans le cadre de l’exécution de vos obligations en tant qu’expert de l’OMSA, vous pouvez occasionnellement être amené à traiter des données personnelles, pour le compte de l’OMSA.
Si vous êtes amené à traiter des données personnelles pour le compte de l’OMSA, vous devez fournir des garanties suffisantes quant à la mise en œuvre de mesures techniques et organisationnelles appropriées, afin que les opérations de traitement soient conformes aux normes généralement acceptées en matière de protection des données.
Lors du traitement de données personnelles pour le compte de l’OMSA, vous déclarez fournir des garanties suffisantes quant à la mise en œuvre des mesures techniques et organisationnelles appropriées, afin que les opérations de traitement soient pleinement conformes aux exigences de la réglementation applicable en matière de protection des données personnelles.
Il est expressément convenu que vous :
- traitez les données uniquement pour la ou les finalités couvertes par votre mandat et les instructions concernant le traitement transmises par l’OMSA ;
- ne pouvez traiter les données personnelles que sur instruction documentée de l’OMSA, y compris en ce qui concerne le lieu d’hébergement et les transferts vers des pays tiers ;
- garantissez la confidentialité des données personnelles traitées sur instruction de l’OMSA ;
- aidez l’OMSA, par des mesures techniques et organisationnelles appropriées, dans la mesure du possible, à remplir son obligation de se conformer à toute demande des personnes concernées concernant leurs droits (droits d’accès, de rectification, d’effacement et d’opposition, restriction de traitement, portabilité des données) et de remplir son obligation de notifier les violations de données personnelles lorsqu’elle le juge opportun ;
- prenez et mettez en œuvre toutes les mesures appropriées pour assurer un niveau de sécurité adapté au risque présenté par les opérations de traitement ;
- sur demande de l’OMSA, supprimez toutes les données personnelles ou les restituer à l’OMSA ou au nouvel expert après la fin de votre mandat ; la restitution de ces données devra s’accompagner de la destruction par vos soins de toutes les copies existantes dans les systèmes d’information de ces derniers.
Orientations pour la gestion des réseaux de Laboratoires de référence l’OMSA
Introduction
Le réseau mondial de Centres de référence de l’OMSA constitue la pièce maîtresse de l’excellence scientifique de l’OMSA. L’une des recommandations de la première Conférence internationale des Laboratoires de référence et des Centres collaborateurs de l’OMSA (célébrée à Florianopolis, Brésil, en 2006) a préconisé l’établissement d’un réseau de Laboratoires de référence et de Centres collaborateurs afin d’harmoniser et de partager les informations, les données et les réactifs de référence dans le but d’améliorer la surveillance et le contrôle des maladies à l’échelle mondiale.
La deuxième Conférence mondiale des Laboratoires de référence et des Centres collaborateurs de l’OMSA (célébrée à Paris en juin 2010) a invité les réseaux de Laboratoires de référence et des Centres collaborateurs du l’OMSA à poursuivre leur collaboration afin de renforcer la coopération multilatérale, en particulier pour produire et rendre plus facilement accessibles des matériels biologiques de référence dûment validés. Afin de consolider cette collaboration, les Laboratoires de référence et les Centres collaborateurs de l’OMSA devront continuer à mettre en commun leurs connaissances et leur expertise et à partager leurs réactifs de référence, dans l’intérêt des Pays Membres de l’OMSA.
Le mandat adopté en mai 2011 prévoit explicitement que les Laboratoires de référence de l’OMSA mettent en place et animent des réseaux, chaque réseau étant formé par l’ensemble des Laboratoires de référence de l’OMSA désignés pour le même agent pathogène. Des informations complémentaires sur le mandat des Laboratoires de référence de l’OMSA sont disponibles via ce lien.
L’OMSA a constaté la nécessité de fournir des orientations complémentaires pour la bonne coordination des réseaux de Centres de référence de l’OMSA. Il s’agit de garantir la cohérence de l’expertise et des avis scientifiques proposés aux Pays Membres, grâce à un meilleur partage de l’information.
L’homogénéité des résultats entre les laboratoires sera garanti par les réseaux de Laboratoires de référence de l’OMSA à travers leur adhésion aux normes de l’OMSA, le partage de réactifs de référence au sein des réseaux et leur participation à des essais d’aptitude inter-laboratoires appropriés. Le développement des réseaux fournira également des possibilités d’échange de connaissances et d’expériences, de soutien mutuel et de développement de collaborations scientifiques. Il aura pour effet d’améliorer la crédibilité et la visibilité des Laboratoires de référence de l’OMSA au niveau mondial, et devrait également inciter d’autres laboratoires de référence nationaux des Pays Membres de l’OMSA à participer à ces réseaux.
Le cas échéant, le Siège de l’OMSA pourra inviter les Laboratoires de référence existants à tenir une réunion (soit physiquement, soit par téléconférence) afin de contribuer à la création d’un réseau, de désigner son secrétariat ou d’appliquer les présentes orientations.
Recommandations :
- Le développement de réseaux entre Laboratoires de référence de l’OMSA fait partie du mandat de ces derniers. Dès lors que deux Laboratoires de référence de l’OMSA, ou plus, ont été désignés pour le même agent pathogène, ces laboratoires doivent constituer un réseau. La participation à ces réseaux est obligatoire pour les Laboratoires de référence de l’OMSA. Les seuls laboratoires à devoir rendre des comptes à l’OMSA sont les Laboratoires de référence de l’OMSA. Néanmoins, d’autres laboratoires de référence peuvent participer à certaines activités du réseau, lorsque cela se justifie.
- Chaque réseau devra se doter d’un secrétariat (et en déclarer officiellement la création à l’OMSA), accueilli par l’un des Laboratoires de référence de l’OMSA participants ; ce secrétariat sera chargé des relations avec le siège de l’OMSA. Il est recommandé que le secrétariat soit responsable de la coordination, du leadership et de la mise en œuvre de la responsabilité du réseau. Le secrétariat peut être assuré par les laboratoires participants sur la base d’une rotation (par exemple tous les trois ans). Il est de la responsabilité du secrétariat du réseau de gérer les conflits d’intérêts et les déclarations de confidentialité q(‘ils sont jugés nécessaires par le réseau et que l’OMSA n’est pas impliquée dans ce processus.
- Chaque réseau devra avoir un plan de travail précis et le secrétariat adressera au Directeur général de l’OMSA un rapport annuel d’activités : accomplissements réalisés, obstacles rencontrés, initiatives futures (les laboratoires individuels peuvent se référer au rapport du réseau dans leur rapport annuel d’activités en tant que Laboratoires de référence de l’OMSA).
- Lors des réunions organisées par le réseau, il conviendra d’autoriser la participation de personnels de l’OMSA en qualité d’observateurs, et de faire préparer par le secrétariat du réseau un rapport de la réunion, qui sera transmis au siège de l’OMSA.
- Dans les cas où le réseau ne parviendrait pas à résoudre une éventuelle divergence de vues ou un désaccord entre les laboratoires participants, le secrétariat du réseau en informera immédiatement le siège de l’OMSA. Celui-ci transmettra cette information à la Commission des normes biologiques.
- Critères d’inclusion sur le site Web de l’OMSA de liens vers le site Web du réseau :
Le réseau peut créer un site Web afin de diffuser des informations sur ses activités. Les réseaux souhaitant qu’un lien vers leur site Web soit ajouté sur le site Web de l’OMSA devront adresser une requête officielle en ce sens au Directeur général de l’OMSA. - Le site Web du réseau devra se conformer aux règles de présentation de la charte graphique de l’OMSA ainsi qu’à d’autres conventions pertinentes de l’OMSA.
- Toute modification majeure intervenant sur le site Web du réseau devra être préalablement notifiée à l’OMSA.
- Le siège de l’OMSA se réserve la possibilité de recommander toute modification de contenu qu’il estimerait appropriée concernant le site Web du réseau, et de supprimer le lien vers le site Web du réseau à tout moment, sous réserve d’en expliquer les motifs au secrétariat du réseau.
- Les rapports et les activités du réseau reflètent les points de vue des membres du réseau et ne reflètent pas nécessairement ceux de l’OMSA.
Contact des réseaux à l’OMSA :
Sara Linnane
Service scientifique
Organisation mondiale de la santé animale (OMSA)
12, rue de Prony
75017 Paris, France
E-mail : [email protected]